对中国肿瘤学界和业界来说,CSCO和ESMO在今年的相遇,注定了本周一定精彩纷呈、热闹非凡,一切以光速前行。虽然这其中也略微交织着些许焦虑、嘈杂和忙乱。
“井喷”的国产创新药
此次ESMO全线上、CSCO线上线下结合的模式,使听者、读者可以手抱电脑、怀揣手机享受无线带来的视觉和听觉盛宴,但各肿瘤治疗领域的专家们仍不可避免地在前拥后簇中成为“空中飞人”,从一个城市到另外一个城市,从颁奖典礼到直播现场,从卫星会场到媒体采访......
尽管重磅研究结果的发布连绵不断,会议日程高速度、快节奏推进,但只要一聊起在9月临床肿瘤治疗“双会”中那些蓬勃而出的肿瘤创新治疗药物的临床研究结果或临床实践时,尤其是当介绍、点评、展望那些中国原研药物,中国研究,中国创新治疗方案时,众人面容上的疲劳、倦意、焦虑即刻烟消云散,取而代之的是敏捷、灵感,激情、激动,气魄和雄心。
以PDx(PD-1/PD-L1免疫检查点抑制剂)和靶向治疗药物为代表的国产创新药物的确没有令人失望,并在此次“双会”上交出了一份比在往届更令人满意的答卷。
和记黄埔的索凡替尼治疗胰腺神经内分泌瘤(p-NET)III期临床试验的结果,以及恒瑞的阿帕替尼联合吉非替尼一线治疗晚期EGFR 突变阳性NSCLC 的III期临床研究(ACTIVE)皆以口头报告的形式在ESMO发布;
恒瑞的PD-1免疫检查点抑制剂卡瑞利珠单抗联合阿帕替尼治疗晚期肝细胞癌(RESCUE)的开放标签、多中心、Ⅱ期研究结果在ESMO以壁报形式发布;
百济神州的PD-1免疫检查点抑制剂替雷利珠单抗联合化疗一线治疗晚期鳞状非小细胞肺癌(NSCLC)的III期临床研究结果在CSCO开幕第一天上午的主会场发布;
君实生物制药的PD-1特瑞普利单抗在标准治疗失败后的局部进展或转移性膀胱尿路上皮细胞癌的单臂II期临床研究结果也紧随其后;
......
在扑面而来、气势如虹的国产创新药大潮下,对于进口创新药最新研发进展的关注趋缓和热度减弱或许也就在情理之中。
本届ESMO大会的LBA(Late-breaking Abstract)的压轴大戏也“爆出”多项重磅研究,比如,分别来自美国百时美施贵宝的纳武利尤单抗(国内俗称的“O药”)和默沙东公司的帕博利珠单抗(国内俗称的“K药”),这两个PD-1免疫检查点抑制剂的“老兵”在治疗消化道和晚期肺癌领域的多项III期临床研究结果都有望改变未来临床实践,但对其的关注热度和广度、解读高度和深度则都已不及仅仅两三年前,当"KO药"还“叱诧风云”,"独领风骚“之时;这不禁令人发问这是不是"KO药"的“中年危机”抑或"廉颇老矣",该把C位让给国内的“后起之秀”们了?
“KO药”的”老当益壮“
在ESMO大会的最后一天(9月22日北京时间凌晨),O药在消化道肿瘤治疗领域的两项重磅III期临床研究结果发布:
CheckMate-577的首轮临床研究结果显示,在中位随访24.4(6.2–44.9)个月时,与安慰剂相比,O药作为辅助治疗用于经新辅助同步放化疗(CRT)和手术切除的食管癌及胃食管连接部癌患者在主要研究终点无病生存期(DFS)上表现出具有统计显著性和临床意义的改善。
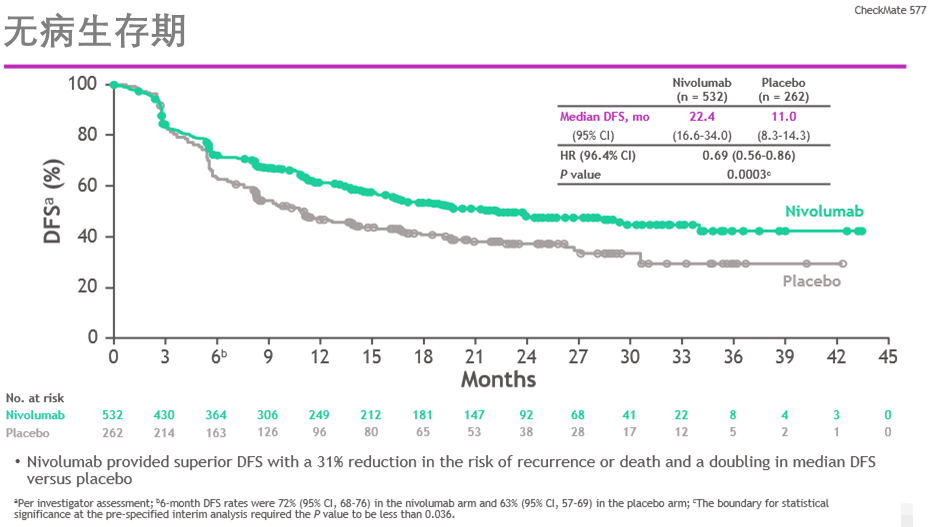
ESMO 2020发布的Checkmate-577的DFS研究结果[1]
CheckMate -649的主要结果显示与单独化疗相比,O药联合化疗一线治疗不可切除的晚期或转移性胃癌、胃食管连接部癌(GEJ)或食管腺癌患者,取得了具有统计显著性及临床意义的总生存期(OS)及无进展生存期(PFS)获益。
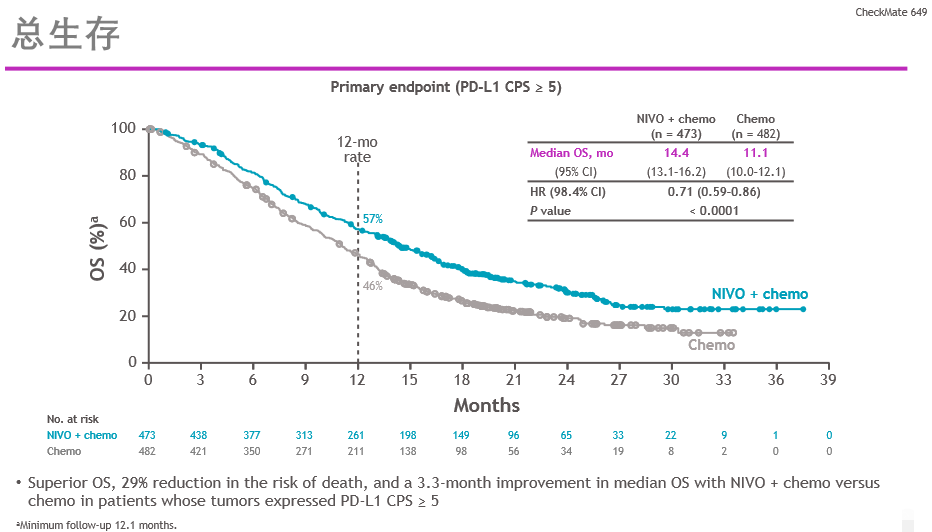
ESMO 2020发布的Checkmate-577的DFS研究结果[2]
面对O药在消化道肿瘤治疗领域的发力,K药在ESMO也公布了KEYNOTE-590研究结果,结果显示K药联合化疗一线治疗食管鳞癌、PD-L1高表达意向治疗(ITT)和食管鳞癌,以及ITT人群中都带来了超过12个月的中位OS,相比几十年未被突破的含铂化疗方案,显示出了具有统计学意义的OS改善和死亡风险的降低。这是全球首个针对食管鳞癌和腺癌以及胃食管结合部腺癌都显示出OS和PFS获益的一线治疗。
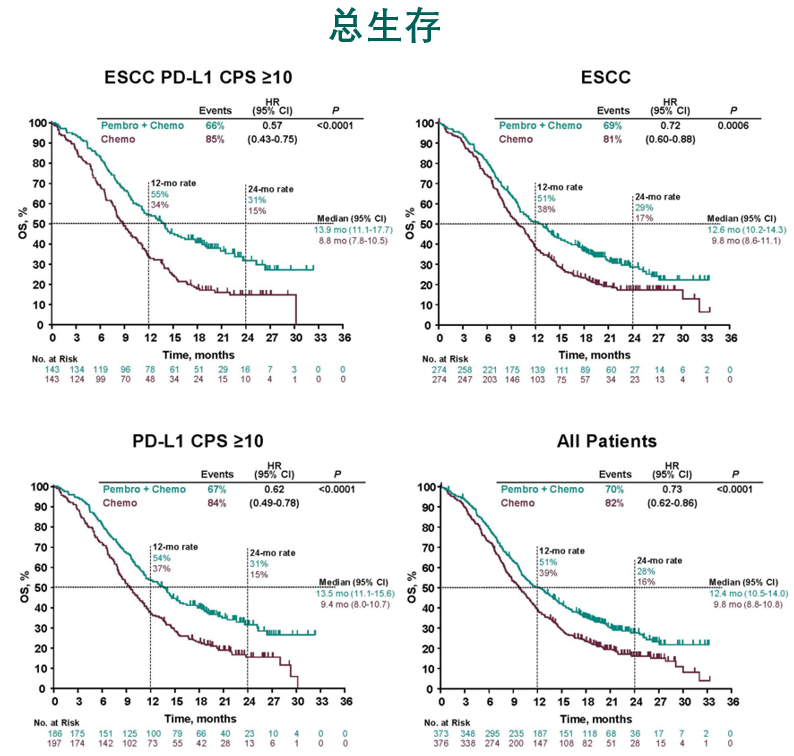
ESMO 2020发布的KEYNOTE-590的OS研究结果[3]
此次在ESMO发布的Checkmate-577、Checkmate-649和KEYNOTE-590研究结果,对于 “KO药"来说都是在消化道肿瘤一线和辅助治疗领域首次的成功“亮剑",其有望改变临床实践的阳性结果对于“KO药"挺进并占领消化道肿瘤免疫治疗市场自然意义非凡。
“KO药”的“老骥伏枥”
相比这几个首次“亮相”的研究,K药在9月21日公布的KEYNOTE-024的五年OS随访研究结果从表面上看就没有那么“性感”了。
然而,在2016年ESMO大会上首次公布中期分析结果的KEYNOTE-024研究是首个PD-1/PD-L1单抗一线治疗晚期恶性肿瘤(PD-L1 TPS ≥50%的非小细胞肺癌)获得成功的III期临床研究,是“KO药”竞争大戏中的一个转折点,是“KO药”斗法的一场“经典战役”,也是推动K药踏上领军肿瘤免疫治疗征程的首个具有里程碑意义的研究。
而此次ESMO大会上公布的KEYNOTE-024五年OS随访结果对于免疫治疗未来发展的指导意义绝不亚于Checkmate-577、Checkmate-649,和KEYNOTE-590,或其它如潮而至的国产PD-1/PD-L1的研究结果。
此次公布的KEYNOTE-024的五年OS随访数据结果显示K药单药居然能让近三分之一的,以往五年生存不到5%的晚期NSCLC患者活过5年。
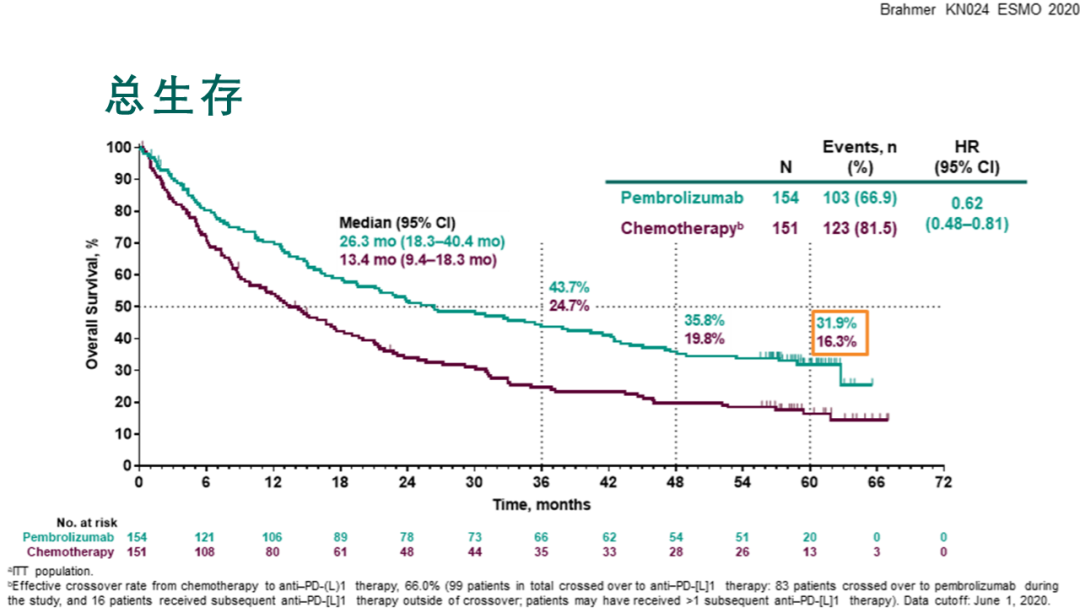
ESMO 2020发布的KEYNOTE-024的五年OS研究结果[5]
而且在研究数据锁定日期(2020年6月)时,在39例完成两年固定K药治疗疗程的患者中,32例仍然存活,而且有18位患者在停药不接受任何治疗的情况下,还存活,且没有出现疾病进展[5]。

KEYNOTE-024:完成两年治疗疗程患者的分析结果[5]
对于免疫治疗带来长生存的探索并非仅限于K药,而K药对于免疫治疗长生存的探研也并非仅限于KEYNOTE-024。
在2019年的世界肺癌大会上, O药单药二线治疗晚期NSCLC的两项III期临床研究Checkmate-017和Checkmate-057的五年(随访至少62.6个月)汇总OS数据(13.4%)也已发布[6]。
O药联合伊匹木单抗的“双免疫”和O药单药一线治疗恶性黑色素瘤的Checkmate-067五年(随访至少60个月) OS数据(分别为52%和44%)也在2019年的ESMO大会发布并刊登于新英格兰医学杂志[7]。
在今年的ASCO大会上,K药单药一线治疗晚期恶性黑色素瘤的五年(中位随访66.8个月)OS数据(43%)[8],O药联合伊匹木单抗治疗一线治疗PD-L1表达阳性(TPS≥1%)晚期NSCLC的三年(中位随访43.1个月)OS数据(38%)[9]也分别发布;
科学研究的“乌龟精神”
在PDx市场竞相推出以ORR和PFS等短期和中期疗效指标为主要终点的II期和III期临床研究结果,以快速推动药品注册、上市和推广的当下,“KO药”对于追求的长生存随访研究的执着则愈发显得“另类”。
然而,“长生存”很可能是“KO药”未来研究的一个“标配”的研究指标。仔细想来,这其实并不奇怪,因为PD-1/PD-L1免疫检查点抑制剂有一个鲜明的特点,也是它们的"阿喀琉斯之踵”:那就是无论哪个PD-1或PD-L1单抗,单药或联合治疗,目前还仅显示针对部分人群有效;但也正是这部分人群,最有可能在接受治疗后获得很长的生存,甚至治愈的机会。
研究“长生存”能带来什么价值?显而易见的价值就是通过这类研究能了解有多少患有某个特定恶性肿瘤的晚期患者能从免疫治疗中得到生存获益。另外,它还有一个更重要的价值,一个关系到未来免疫治疗研究方向的价值。
如果能知道获得长生存的患者有何不同之处,那就有可能找到打开免疫治疗长生存 “大门”的钥匙。但是前提是必须找到这些获得长生存的患者。显而易见,唯有通过长期随访研究才能做到这一点。
然而,研究免疫治疗的长生存很昂贵,因为它需要时间,需要耐心,需要沉下心,并像“乌龟”一样的慢。
此次ESMO公布的KEYNOTE-024的五年OS研究的中位随访时间是59.9个月,最长的随访时间将近7年(68.4个月)。
结尾 - “兔龟”复合体
今年9月8日,包括阿斯利康、葛兰素史克、强生、默沙东、辉瑞、赛诺菲等全球知名的九家生物制药企业的CEO签署并宣布一份历史性誓言,共同承诺在未来向全球监管机构提交COVID-19疫苗的申报资料和审批申请时将坚守科学诚信。
在誓言中,九位CEO承诺将严格遵守高标准的伦理要求和坚实可靠的科学原则。FDA已为COVID-19疫苗的研发做出了明确的指导原则,并为疫苗在美国的潜在授权和获批设立了明确标准。具体而言,FDA要求用于申请监管审批的科学证据必须来自大批量、高质量的随机、盲测者参与的临床试验,需要有恰当的研究设计和多元人群的广泛参与。
其中的一位CEO在接受美国某电视台的采访时强调,当全球正在加紧研发预防时,公众必须要有耐心,并严格遵守科学原则,“You can't rush science"。
国内的免疫治疗药物正蓬勃而出,针对这些药物的研究也在持续地高速发展,可谓势不可挡。但同时,人们也应该要意识到药物研发需要驻足思考和沉淀的时刻,要给予研究者和临床医生把自己“束之高阁”,闭门冥思的时间。,
因此,乌龟的迟钝缓慢和兔子的跳跃灵动都需要有,而且一定要把握好何时做乌龟,何时做兔子。
在2016年10月,几乎于KEYNOTE-024研究同时公布结果的Checkmate-026研究得到了一个阴性结果,原因至今不详,但两个研究的一个重大的差异就在于,Checkmate-026选择了PD-L1表达TPS≥5%的人群,而K药则选择了患者群体更小的TPS≥50%的人群。
科学研究需要从纯净的、单一的科学初衷出发,一旦上路,往往就需要耐心和等待。
但在应该按科学办事儿的时候让“兔子”跑出来"扑腾”,结果则往往适得其反。
参考文献:
[1] Ronan J. Kelly et al., Adjuvant nivolumab in resected esophageal or gastroesophageal junction cancer following neoadjuvant chemoradiation therapy: first results of the CheckMate 577 study, ESMO 2020, LBA9
[2] Markus Moehler et al., Nivolumab plus chemotherapy versus chemotherapy as first-line treatment for advanced gastric cancer/gastroesophageal junction cancer/esophageal adenocarcinoma: first results of the CheckMate 649 study ESMO 2020, LBA 6
[3] Ken Kato et al., Pembrolizumab Plus Chemotherapy Versus Chemotherapy as First-Line Therapy in Patients with Advanced Esophageal Cancer: The Phase 3 KEYNOTE-590 Study, ESMO 2020, LBA 8
[4] Reck M,et al. Pembrolizumab versus Chemotherapy for PD-L1–Positive Non–Small-Cell Lung Cancer[J].N Engl J Med,2016,375:1823-33
[5] Brahmer JR,et al.KEYNOTE-024 5-year OS update:First-line(1L) pembrolizumab(pembro) vs platinum-based chemotherapy(chemo) in patients(pts) with metastatic NSCLC and PD-L1 tumour proportion score (TPS) ≥50%[EB/OL].ESMO 2020,abstract LBA51
[6] Gettinger S et al., Five-Year Outcomes From the Randomized, Phase 3 Trials CheckMate 017/057: Nivolumab vs Docetaxel in Previously Treated NSCLC. 2019 WCLC, Abstract OA14.04
[7] James Larkin et al., Five-Year Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma, October 17, 2019, N Engl J Med 2019; 381:1535-154
[8] Long GV., Long-Term Survival From Pembrolizumab Retreatment: Phase 3 KEYNOTE-006 in Advanced Melanoma, 2020 ASCO, Oral Presentation.
[9] Suresh S. Ramalingam et al., Nivolumab+ipilimumabversusplatinum-doubletchemotherapyasfirst-line treatment for advanced non-small cell lung cancer: Three-year update from CheckMate 227 Part 1. 2020 ASCO Abstract 9500
四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..