检测试剂的生产质控与诊断试剂的评价既有相同点,因为都是基于相同的评价指标;又有不同点,生产过程会关注原料、半成品、成品,诊断试剂评价只针对成品。
本章的很多内容基于《核酸检测试剂生产及质量控制技术指导原则》,但是这个原则缺乏可操作性,因此又进行了扩展和延伸,供大家参考。
01
原材料
1.dNTP
脱氧三磷酸核苷,核酸的组成成分,包括:dATP、dUTP、dGTP、dCTP和dTTP。
应为HPLC纯、PCR级,无DNase和RNase污染。-20℃保存。
2.引物
由一定数量的核苷酸构成的特定序列,通常采用DNA合成仪人工合成,合成后经聚丙烯酰胺凝胶电泳或其他适宜方法纯化。
冻干粉,1800D以上。序列正确。纯度应达到电泳级(PAGE)或HPLC级,不含杂带。应提供合成机构出具的合成产物的质检证明,如PAGE电泳结果或HPLC分析图谱。
应作HPLC分析和紫外光吸收分析。以紫外分光光度计测定OD260nm/OD280nm的比值在1.6~2.0之间,可视为合格引物。-20℃保存。
3.探针
是指特定的带有示踪物(标记物)的已知核酸片段(寡聚核苷酸片段),能与互补核酸序列退火杂交,用于特定核酸序列的探测。通常采用DNA合成仪人工合成,合成后经聚丙烯酰胺凝胶电泳或其他适宜方法纯化,在5-端标记荧光素报告基团或其他发光标记物,在3-端标记荧光素淬灭基团,并经HPLC或其他适宜方法纯化。
冻干粉,90D以上。纯度应达到HPLC纯,不含杂带。应提供合成机构出具的合成产物的质检证明,如HPLC分析图谱;应对探针的核酸序列及标记的荧光素或化学发光物进行核实,并作HPLC分析。应以可见—紫外分光光度计进行200~800nm扫描,在260nm处应有吸收峰。另外,根据标记的荧光素的不同,还应该在荧光素的激发波长处有吸收峰,如FAM荧光素在494nm、TET荧光素在521nm、TAMRA荧光素在560nm处有特异的吸收峰,杂交探针在493nm、625nm、685nm处有特异的吸收峰,检定合格后入库。避光、-20℃保存。
4.Taq DNA聚合酶
具有DNA聚合酶活性,无核酸外切酶活性及核酸内切酶活性;具热稳定性,94℃保温1小时后仍保持50%活性。-20℃保存。
5.UNG(尿嘧啶糖基化酶)
具有尿嘧啶糖基化酶活性,无核酸外切酶及核酸内切酶活性,IU UNG在 37℃处理3分钟后,103拷贝以下含U模版应完全降解,不能产生扩增产物。-20℃保存。
6.RT-PCR酶(反转录扩增酶)
具逆转录酶活性和DNA聚合酶活性,无核酸外切酶及核酸内切酶活性;具热稳定性,94℃1小时后仍保持50%活性,-20℃保存。
02
半成品与成品的质控
半成品与成品的质控基本上基于相同的评价指标,这里就合并在一起了。
1.精密度/重复性
指在同一实验室使用相同方法进行批内与批间测量的一致性。
1.1 样品:
至少三个水平
阴性样本:待测物浓度低于最低检测限或为零浓度
临界阳性样本:待测物浓度略高于试剂盒的最低检测限
中/强阳性样本:待测物浓度呈中度到强阳性
1.2 评价指标:
检出率:阴性样品和中/强阳性样本检出率为100%,临界阳性样本阳性检出率应≥95%。
变异系数:通常使用变异系数(CV)来评价重复性,一般要求CV≤10%,qPCR检测试剂Ct值的CV≤5% 。
1.3 批内重复性:
同一批试剂,至少高/中,临界和阴性3个水平的样品,进行3次以上重复。
1.4 批间重复性:
至少3批试剂,至少高/中,临界和阴性3个水平的样品,不同的时间,经不同的操作者,进行至少20次的测定。
2.灵敏度/分析敏感性/最低检测限
这里有2个指标需要评价一个是最低检测限,一个是线性。
2.1 评价指标:
使用相同基质稀释病原体、质粒、假病毒等。
最低检测限:qPCR低于样品中1000 copies/mL或10 copies/reaction。
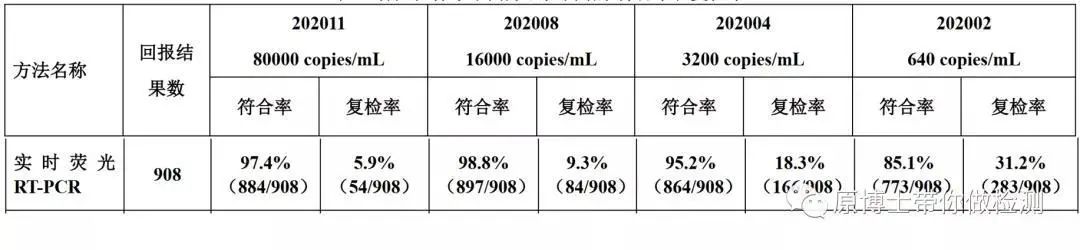
在《2020年新型冠状病毒核酸检测室间质量评价结果报告》中样品设置的浓度最低为640 copies/mL,各厂家检测结果如下图。而各试剂厂家标识的最低检测限分别为:
北京卓诚惠生(200)、华大生物(100)、上海伯杰(1000)、上海捷诺(500)、上海之江(1000)、圣湘生物(200)和中山达安(500)。
≤1000 copies/mL也是主流厂家普遍采用的最低检测限,如果考虑到提取过程浓缩2-5倍和加模板量的2-5μL,换算为copies/reaction约为10。
3.线性:R2>0.98,扩增效率(90%-110%)
2.2 评价指标:
最低检测限的评估应该分2步进行,首先选择已知量值的模拟样品(DNA病毒为质粒或假病毒,RNA病毒为假病毒)或临床样品进行倍比稀释。
使用梯度稀释法,每个浓度梯度最少重复3次检测,以100%可检出的最低浓度水平作为估计检测限。
在此浓度附近制备若干梯度浓度样品,每个浓度至少重复20次检测,将具有90%~95%阳性检出率的最低浓度水平作为确定的最低检测限。
2.3 线性:
至少5个浓度,每个浓度至少3次重复。
3.分析特异性/交叉反应
将样品基质中的目标分析物与其他成分区分开的能力,如宿主DNA、血液组织等基质。
3.1 非目标微生物:
其他非目标微生物或其他非目标亚型微生物。
3.2 内源性干扰物:

3.3 外源性干扰物:

3.4 常见干扰物建议试验浓度:
根据自身情况自己选择。

4.符合率
测试临床样品的诊断敏感性和诊断特异性。
5.稳定性
应对需要进行稳定性考核的试剂成分,在特定温度或条件下进行稳定性试验。稳定性试验可采用加速破坏试验。
03
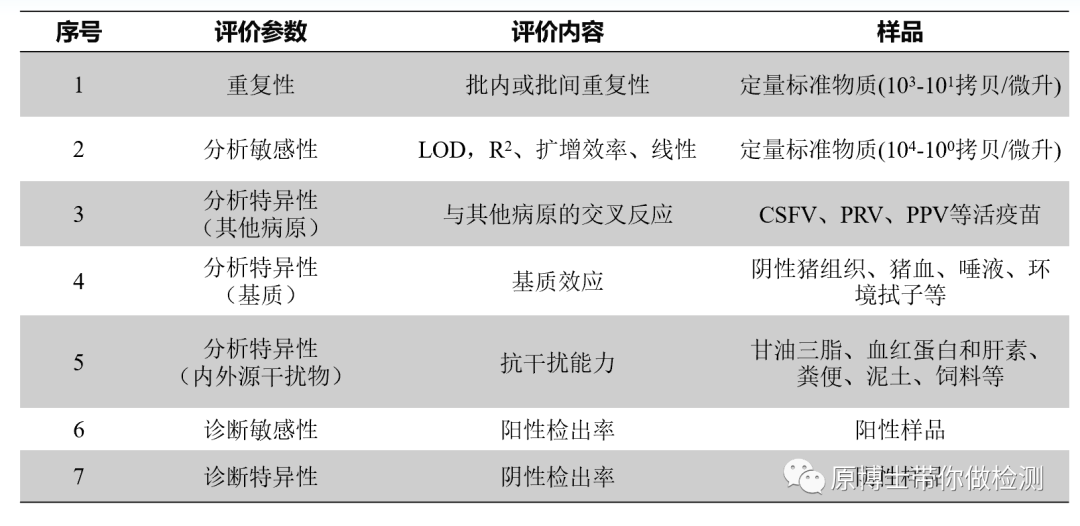
质量控制样品盘
上述的指标可以通过制备一个样品盘同时对多指标进行质控。如下图▼
04
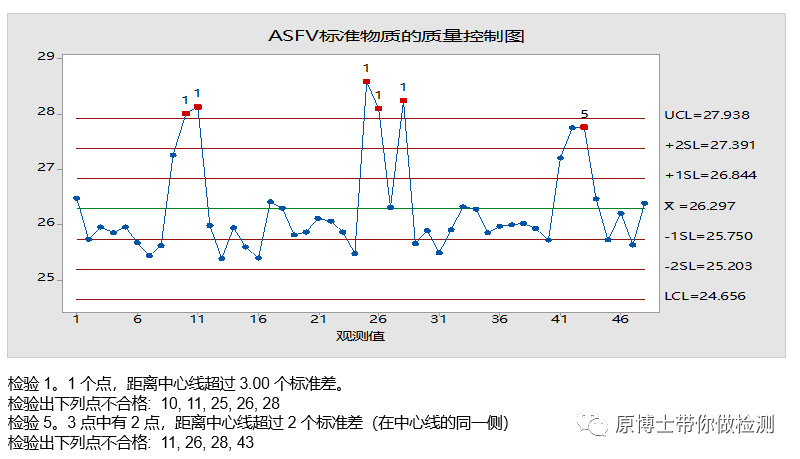
质量控制图
生产企业的质量控制最常用的工具就是质量控制图。目前最广泛使用的质量控制图是Levey-Jennings chart结合Westgard rules质控规则。
通过标准物质或者定值质控品对每批次产品进行质控进而绘制质量控制图可以更科学的评估每批次产品的质量。
05
计量溯源性
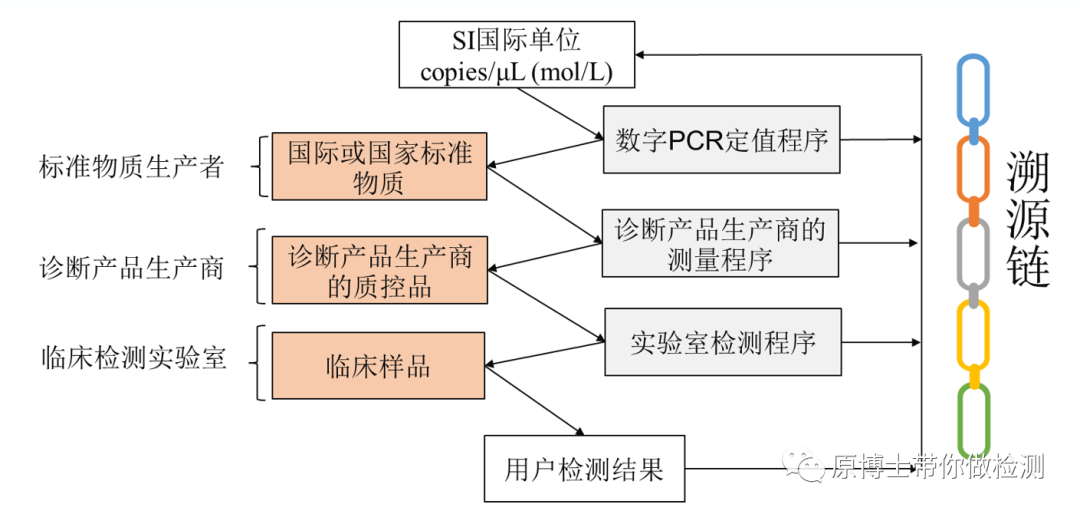
在有国际标准物质或国家有证标准物质/标准样品的情况下,诊断试剂生产企业应主动的将标准物质/标准样品应用到产品中,以保证诊断试剂可以溯源到准物质/标准样品。
小结
实验室自制的试剂由于缺乏严格的质量控制,无法做到产品质量的稳定可靠,本人是不认同的。核酸检测试剂生产企业的质量控制标准属于每个企业的内部标准,可以使用最低标准也可以使用更严格的标准。这取决于每个企业对产品质量的要求。
我希望在中国的市场上大家追求的是“高质高价”而不是“物美价廉”。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..