作者 | 辛铃
如果你认为Covid-19延缓了美国食品和药物监督管理局(FDA)的新药审批,那就大错特错了。即使疫情蔓延期,FDA却似乎比以往任何时候都更加活跃。2020年截至6月底,美国FDA已经批准了33种新药,依照这一趋势来看,2020年的新药审批情况或与过去两年基本一致(2018年批准了62种新药,2019年为54种)。
与此同时,欧洲药品管理局(EMA)也忙得不可开交,该监管机构上半年批准了41种药物,其中27种为新疗法。
在FDA批准的33种新药中,药物审评和研究中心(CDER)审准了25种新分子实体和新的治疗性生物制品,其中几乎一半(12种)是肿瘤药物。EMA批准的新药中肿瘤领域(10种)药品同样占主。

根据FDA和EMA上半年批准新药的适应症和市场竞争力进行分析后,Pharma Compass近日预测了销量TOP10的药物,如下表:
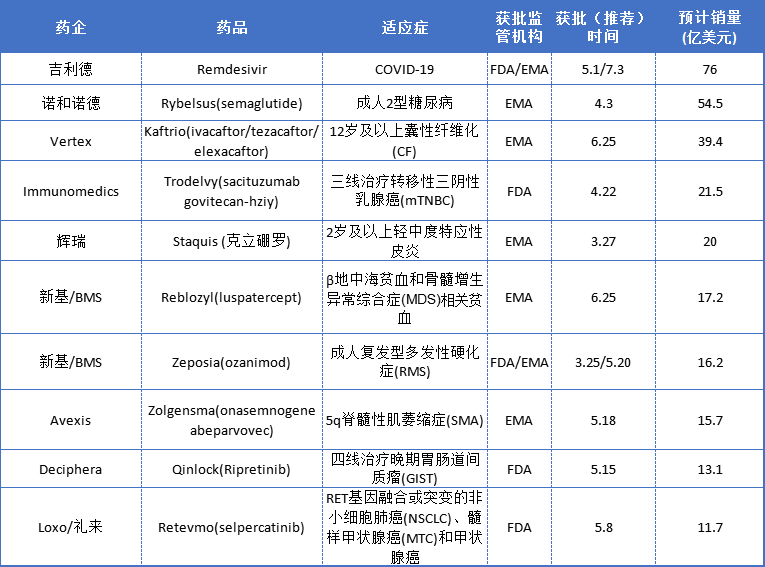
有条件批准的Remdesivir成为今年最大赢家
吉利德Remdesivir(瑞德西韦)无疑是今年谈论最多的药物之一。尽管该药部分研究仍在临床评估中,但美国FDA、欧洲EMA和日本厚生劳动省(MHLW)均为这种药物提供市场准入。
今年5月1日,FDA根据所获得的全部科学证据,率先签发了紧急使用授权书(EUA),认为Remdesivir可能对治疗Covid-19有效,且治疗Covid-19的已知和潜在益处大于其风险。6月25日,EMA人用药品委员会(CHMP)发布了积极意见,建议授权该药(欧洲商品名Veklury)“有条件”销售。
Remdesivir一上市便供不应求,美国购买了超过50万剂,这是吉利德公司7月份100%、8-9月90%的产量,因此几乎没有留给英国和欧洲多少库存。在127个低或中等收入国家,吉利德允许非专利制药商供应该药,进一步扩大供应。
除了Remdesivir以外,大部分药物均依照先美国后欧盟的顺序获批,如三药组合Trikafta(美国商品名),因出色的临床数据在上市申请提交后3个月(2019年10月)就获得了FDA批准。今年6月,EMA采纳了CHMP的积极意见,也授予该组合药物Kaftrio(欧洲商品名)营销权。又如诺华/Avexis的Zolgensma、诺华Piqray、辉瑞Staquis和Daurismo等,均于2019年获得FDA批准。
多款“首个”药物获批
今年也见证了近20年来第一个非他汀类药物在美国获准销售。该药物名为Nexletol(bempedoic acid),由Esperion Therapeutics生产,旨在帮助数百万不能忍受或不能从广泛使用的他汀类药物(如立普妥和可定)中获得满足的患者降低胆固醇。这种新药将作为他汀类药物的附加疗法,通过抑制有害胆固醇或低密度脂蛋白(LDL)在肝脏中的合成从而降低其总量,能够针对心血管高危患者。此外,bempedoic acid与另一种降低胆固醇药物ezetimibe联合应用也获得批准。
而Trodelvy作为FDA批准的第一个用于复发或难治性mTNBC的抗体药物偶联物(ADC)药物,也是第一个抗糖蛋白Trop-2的ADC药物,对激素疗法和HER2靶向疗法(如Trastuzumab)均无效的TNBC患者带来了希望。该药物通过抗体与大多数乳腺癌细胞上表达的 TROP-2 抗原结合,将化疗药物伊立替康直接递送至肿瘤细胞微环境中,还能够将药物递送到不表达 Trop-2 的肿瘤细胞附近,从而降低以往系统性给药所带来的毒性作用。
近20种药品未获得批准
在疫情挫折下,有些药物的审批也并非顺利。今年上半年约有20种新药遭到了FDA的拒绝信函,包括百时美施贵宝(BMS)和蓝鸟生物用于复发性和难治性多发性骨髓瘤的CAR-T疗法idecabtagene-Vicleuel(ide cel),FDA认为其生物制品许可证申请(BLA)的化学、制造和控制(CMC)模块需要提供进一步的细节以完成审查,但不需要额外的临床或非临床数据。
此外,Intarcia Therapeutics的2型糖尿病长期植入式药物ITCA-650在收到拒绝两年后再次被拒,据悉该植入物被设计成一个小的渗透泵,可以在皮肤下滑动,并连续提供6个月剂量的GLP-1激动剂exenatide(艾塞那肽)。
FDA也没有批准Intercept制药的非酒精性脂肪性肝炎(NASH)治疗药物obeticholic acid,原因是不相信该药的益处大于潜在的风险。
在以630亿美元收购了艾尔建后,艾伯维希望针对新生血管(湿)年龄相关性黄斑变性(nAMD)的实验性DARPin®疗法Abicipar pegol成为获得批准的首批药物之一。然而FDA的研究指出,在给药后观察到患者眼内炎症率增加,产生了不利的效益-风险比,因此拒绝了该药。
总结
当所有人的注意力都集中在Covid-19大流行的时候,监管部门则忙着让新药上市。到了年中的时候我们意识到,FDA和EMA似乎有望在今年创造批准记录,因为今年6月之前获批的药物数量几乎是去年同期批准数量的两倍。
虽然批准数量不减,但Covid-19大流行却对药品顺利上市形成了阻碍,进而造成销售损失。BMS的多发性硬化症治疗药物Zeposia(ozanimod)目前在美国和欧洲都获得了批准,是今年最令人期待的药物批准之一。同时,该药物也是BMS花费740亿美元收购新基(Celgene)、并为两家公司投资者获得收益回报的核心产品。然而由于疫情全球爆发,Zeposia上市将被推迟。
在目前全球这样一个流动性可能受到限制、人际和商业往来大幅减少的情况里,企业如何调整其销售和营销战略,仍有待观察。
参考资料
1.New Drug Approvals by FDA & EMA (Mid-2020 Recap)
2.US secures world stock of key Covid-19 drug remdesivir
3.Bristol Myers Squibb and bluebird bio Provide Regulatory Update on Idecabtagene Vicleucel (ide-cel, bb2121) for the Treatment of Patients with Multiple Myeloma
4.INTERCEPT RECEIVES COMPLETE RESPONSE LETTER FROM FDA FOR OBETICHOLIC ACID FOR THE TREATMENT OF FIBROSIS DUE TO NASH
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..