7月24日,欧盟EMA的人药委员会(CHMP)做出一项关于生物等效性研究CRO的审查建议:由于数据完整性问题,对于依赖印度CRO公司Panexcell数据而上市的仿制药,在欧盟范围内将暂停上市许可。目前,共有30多个药品牵涉其中。

关于Panexcell
该CRO名为Panexcell临床实验室(Panexcell Clinical Laboratories Priv. Ltd),其官网显示,该公司成立于1998年。成立之初,仅拥有一个HPLC(高效液相色谱)和四个成员的团队;而现在依靠其持续的“成功”,Panexcell已转移到了位于新孟买的更大场所,致力于成为全球“一流”的合同研究组织。
审查背景
CHMP这项审查的背景是,奥地利和德国检查员发现:Panexcell进行生物等效性研究的方式不符合规定。Panexcell的这些研究是为了表明,仿制药在体内的活性物质含量与参比制剂相同。
检查发现来自不同患者的样品异常相似,另外样品处理区域的室温记录也存在错误。这些发现,使检查员对Panexcell的质量管理体系和数据可靠性产生了严重的担忧。
应德国的要求,根据第2001/83 / EC号法令,2020年2月EMA启动了第31条审核程序。这项审查具体是由EMA的CHMP负责进行。

审查结论
对于由Panexcell代表欧盟MAH研究的所有药品,CHMP进行了查看,发现没有其它来源的充足数据,来支持药品的有效性。
因此,委员会建议,对于欧盟范围内许可的药品,如果其生物等效性研究是由Panexcell进行的,将暂定其上市许可。为了解除暂停,此前依赖于Panexcell数据的这些公司,需要向欧盟提供替代数据,以证明生物等效性。
基于Panexcell数据而目前正在进行上市评估的药品,在欧盟内将不会获得上市批准。
EMA表示,EMA和国家主管部门将继续紧密合作,确保对欧盟药品的研究达到最高标准,并确保公司遵守良好临床规范(GCP)的所有要求。如果公司不符合标准要求,当局将采取一切必要措施,以确保用于欧盟药品批准的数据完整性。
CHMP认为,已经得出最终审查结论,现在可以移交欧盟委员会。欧盟委员会将适时发出具有法律约束力的最终决定,而该决定将适用于所有的欧盟成员国。
给患者和医护人员的信息
CHMP建议:
由于对仿制药进行测试的公司可能不可靠,因此某些仿制药正在欧盟市场暂停销售。
目前没有证据表明任何受影响的药物有害、或缺乏效力。
但是,这些药物将被暂停使用,直到获得更可靠来源的支持数据为止。
请使用替代药物。服用受影响药物的患者,可以联系他们的医生或药剂师,以获取更多信息。
有关药物的更多信息
CHMP审查内容涵盖了已通过欧盟国家程序上市、或正在评估的仿制药。这些药物已在丹麦、芬兰、法国、德国、马耳他、荷兰、西班牙、瑞典和英国获得批准,或正在评估上市许可。目前共有30多个药品牵涉其中:
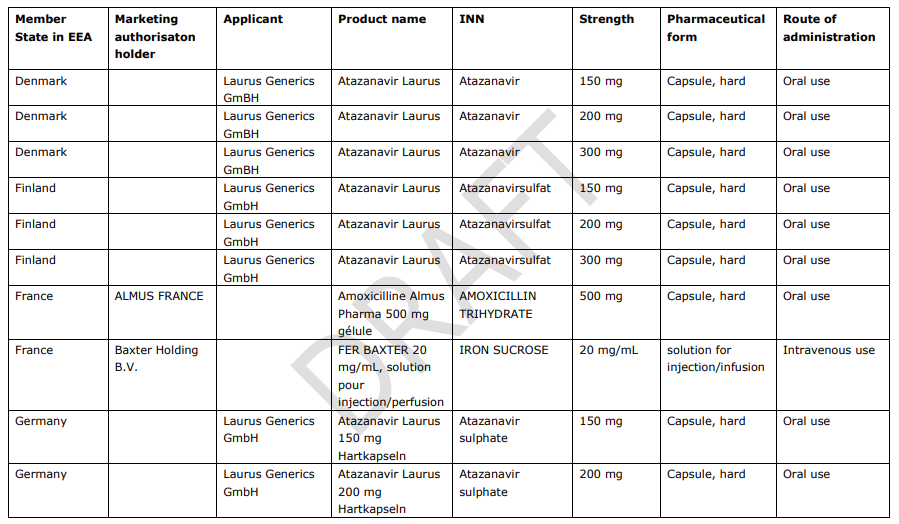
图:牵涉生物等效性数据问题的部分仿制药
Ref.: [EMA][2020-07-24]Panexcell Clinical Laboratories: suspension of medicines over flawed studies
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..