
本篇节选自2019项目报告《监测人用药品注册技术要求国际协调会议(ICH)指南的执行和落实情况》。点击文末【阅读原文】获取完整报告下载
概述
背景信息:根据ICH 组织章程规定, ICH 的监管机构成员应执行ICH 指南。ICH 议事规则规定,大会应建立一套程序监测国际统一和协调工作的进展情况,并提供ICH 指南的执行和落实现状。
目的:本研究的目的是收集监管机构和企业对ICH 指南执行和落实情况的看法,并利用调研结果进行差异分析。长期目标
是建立可持续的ICH 驱动机制来对指南进行长期评估,以便为ICH 利益相关方提供目标中所述的多个领域信息。
方法:国际监管科学创新中心(CIRS)与ICH 和ICH 执行委员会合作开发了一套在线调查问卷和定义。由企业(评估所有
参与的监管机构)和监管机构(仅进行自我评估)填写调查问卷,以进行差异分析。

结果:总体而言,有明确证据表明指南得到充分执行和落实。
ICH 指南的执行情况: 基于自我评估,创始/ 常任监管机构成员中的指南执行程度最高,其次为监管机构成员和观察员。企业对执行情况的看法基本与监管机构相同,但也发现一定差异:如E2B 和M8。
ICH 指南执行的充分性(基于修订情况):一般而言,监管机构表示大部分指南都不加修订直接执行(= 充分执行),而一部分指南有较多修订,如Q1、Q7、E2D。对于修订的指南,所有监管机构均认为修订具有客观依据(= 充分执行),且一般而言,企业的看法与监管机构的自我评估一致。
ICH 指南的落实情况:在确认执行的监管机构中,所有机构均认为本机构能够落实指南要求,即在日常工作中充分应用指南。一般而言,企业的看法与监管机构的自我评估一致,或者现有经验有限,尚无法得到评估结论,如E17。
结论:研究的第2a 阶段表明可进行全面综合的意见调查,而且回复率极好,表现出各方对该项目具有浓厚的兴趣。基于证据原理支持的回复表明,监管机构与企业的观点基本一致,但存在一些差异。依据和具体实例能够充分支持这些差异,但是,可利用差异和分歧来评估监管机构和企业在培训及能力建设方面做出的努力。应注意,数据有一定局限性,有可能一些企业因对调查问题的误解或与监管机构的沟通经验有限而不能如实反映某一地区的指南执行情况。例如,一些企业指出,在预期进行合理修订的情况下,未落实指南,如翻译要求。因此,虽然可以利用这些结果来支持与ICH 成员申请的相关决策、指南执行情况的透明沟通及ICH 指南未来的修订,但应谨慎考虑调研结果的适当应用及结果是否经过确认。
背景信息
ICH议事规则规定,大会应建立程序监测国际统一和协调工作的进展情况,并掌握此方面ICH指南执行和落实的现状。预计预期将来ICH监管机构将在未来执行所有ICH指南,并鼓励监管机构直接执行ICH指南。为实现协调统一,除具有客观依据的偏差外,应避免向ICH指南中增加监管要求或从中删除重要监管要求。ICH还意识到,并非所有指南均具有同样重要的地位,因此ICH指南按照优先级别分为层级1、层级2和层级3。
对于ICH协会成立后加入的监管机构成员,需要一定时间才能执行全部指南,所以只能在执行程序完成后2-3年时才能评估指南的执行和落实情况。因此本次评估的重点集中在已执行指南的执行和落实情况。
ICH创始行业工业界成员已代表ICH认可,可同意在2017年进行一次1期尝试性试研究,以获得企业对ICH指南执行和落实情况的观点和看法。CIRS作为独立第三方机构开发了一套概念验证调查问卷,对用于调研PhRMA/EFPIA/JPMA企业成员对层级1和2的ICH指南的执行和落实情况的观点和看法进行调研。1期研究结果表明,可对各公司进行问卷调查,回复率较好,表明企业对该项目具有浓厚的兴趣。
本报告所述项目阶段(即2a期)的目的是在1期调研结果和经验基础上继续进行研究。ICH再次选择CIRS进行2期研究,以便对监管机构对ICH指南的执行和落实情况进行监测。随后,CIRS与ICH合作开发了研究调查问卷和在线数据收集工具(DCT)。由企业和监管机构(仅进行自我评估)填写调查问卷,以进行差异分析。
目标和目的
本研究的目的是收集监管机构和企业对ICH 指南的执行和落实情况的看法,并利用调研结果进行差异分析。总体研究目的是:
• 了解与监管机构成员申请相关的ICH 决策
• 为ICH 成员和观察员提供内部考量的额外数据
• 发现法规培训和能力建设的需求
• 了解工业界和监管机构相关举措
长期目标是建立可持续的ICH 驱动机制来对指南进行长期评估,以便为ICH 利益相关方提供目标中所述的多个领域信息,进而履行ICH 的使命。应注意,CIRS 已对本报告中列出的回复进行分析,并分享给参与的监管机构,另外还在阿姆斯特丹举行的2019 ICH 大会和管理委员会会议上就分析结果进行报告。
方法
CIRS 与ICH 合作开发了研究调查问卷和在线数据收集工具(DCT)。ICH 执行委员会还与CIRS 共同建立了指南的“执行”和“落实”的定义(见附件1)。2019 年2 月至4 月,企业(评估所有参与的监管机构)和监管机构(仅进行自我评估)填写调查问卷,以进行差异分析。用4 个简短问题评估各监管机构内各指南的执行/ 落实情况(完整调查问卷见附件2):
1. 指南的执行状态(基于监管机构的自我评估):未执行;正在执行过程中;已执行;不适用
2. 对ICH 指南的修订与监管机构是否为修订提供客观依据(即提出明确建议并帮助工业界实施,但未增加负担)
3. 指南的落实情况(基于监管机构的实践):落实;未落实;由于经验有限尚无法评估
4. 如选择“未执行”或“未落实”,应提供选择依据,包括特定证据和实例
对下列ICH 指南进行评估:
• 层级1:
o Q1 – 稳定性(考虑所有子部分)
o Q7 – 原料药生产质量管理规范
o E6(R2) – 药品临床试验管理规范(GCP)
• 层级2
o E2A – 临床安全性数据管理:快速报告的定义与标准
o E2B(R3) – 临床安全性数据管理:个例安全报告传输的数据元素
o E2D – 获批后临床安全性数据管理:快速报告的定义与标准
o M1 – 用于监管活动的医学术语词典(MedDRA)
o M4– 通用技术文件(CTD)
• 层级3
o M3(R2) - 药品人类临床研究和上市批准中非临床安全性研究指南
o M8 - 电子版通用技术文件(eCTD)
o E17 – 计划与设计多区域临床试验的总体原则
下列组织参与调查并进行差异分析:
• 15 家监管机构(仅进行自我评估),来源于:

• PhRMA、EFPIA、JPMA、BIO 和IGBA 成员企业中,52 家大型制药企业(评估所有参与的监管机构)受邀参加。
结果:第1部分:参与企业的特点
在受邀的52 家企业中,有32 家企业提交了15 家监管机构的调查回复。
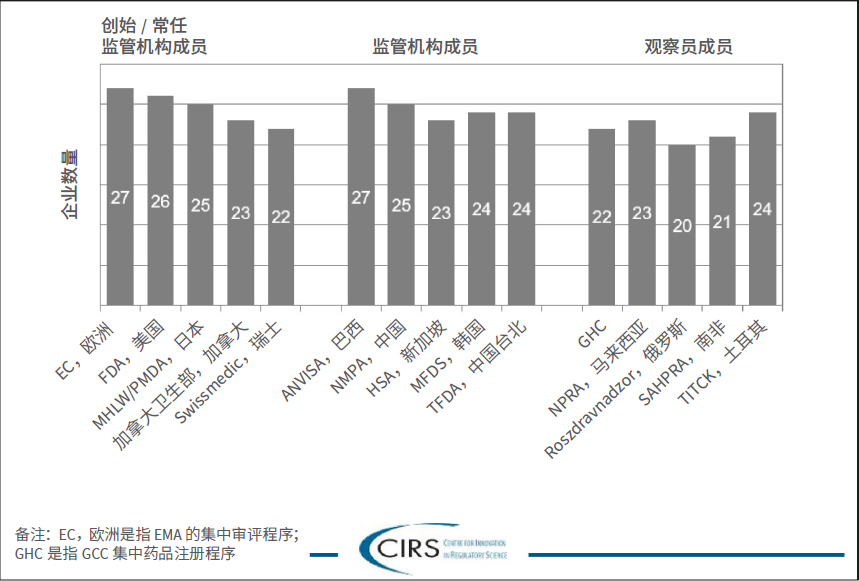
经验:要求企业提供选定监管机构关于指南的最近或相关经验。
关键信息:大部分企业拥有与全部监管机构交流的经验,其中创始/ 常任监管机构成员的行业经验最丰富,其次为监管机构成员和观察员。
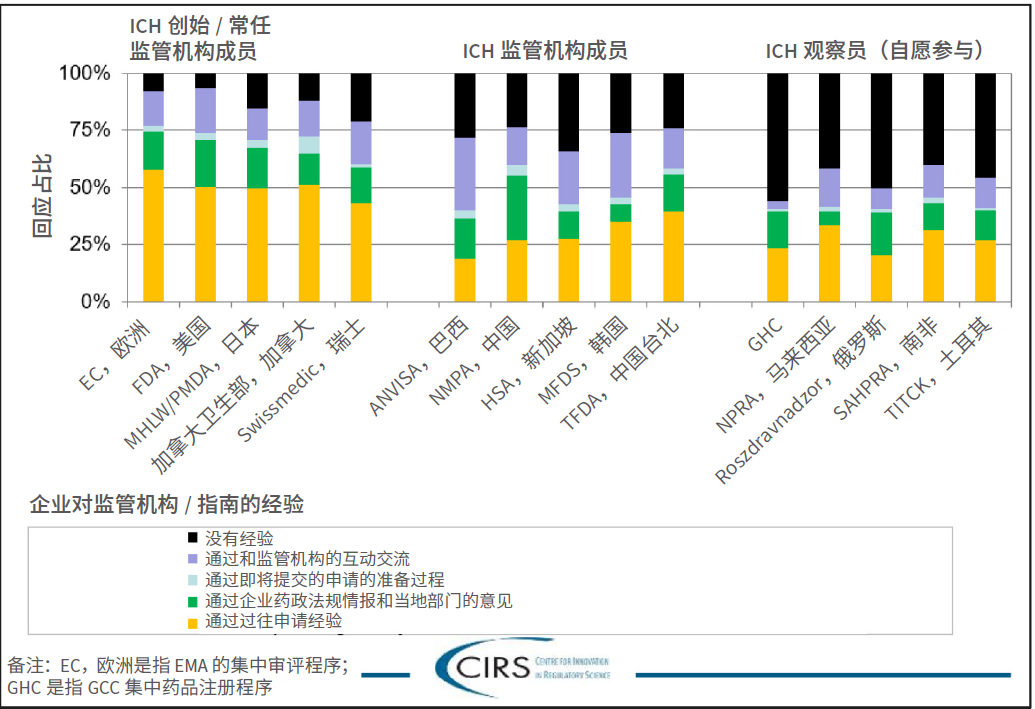
说明:仅邀请拥有特定监管机构(通过与监管机构交流或提交注册申请)经验的企业对调查问卷的其余部分进行回复,因为后续问题中的回复意见在与公司的整体经验相关,而不仅与选定的单次申请或经验相关。
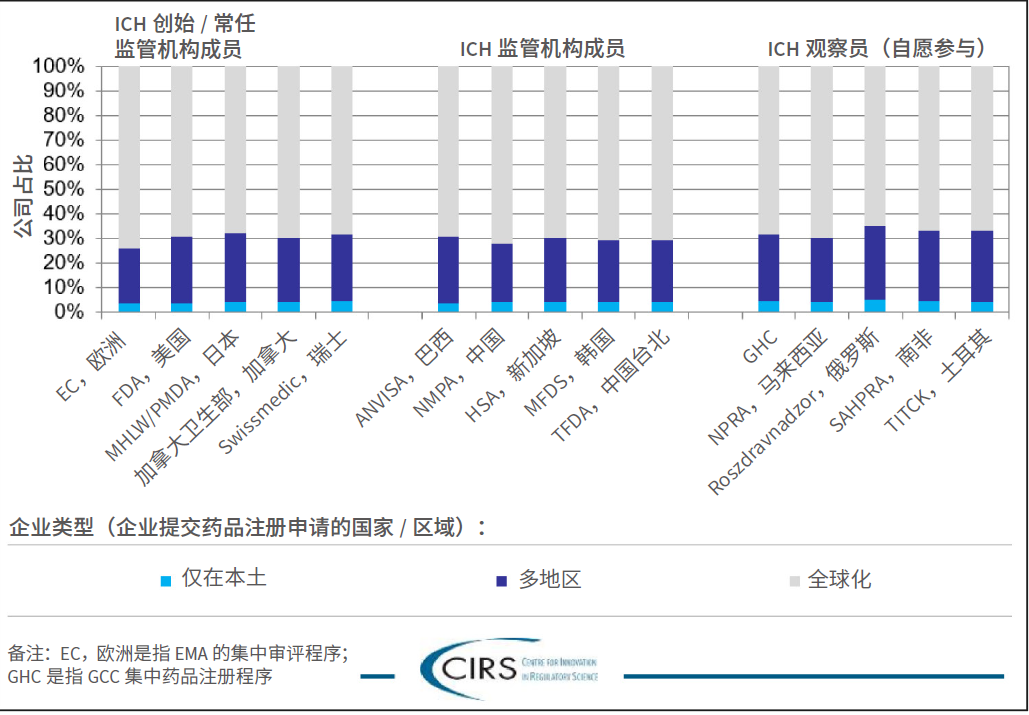
企业类型:按照企业递交药品注册申请的国家/ 地区对参与企业进行分类,例如本土、区域、全球。
关键信息:约70% 的企业为全球公司,且不同监管机构该比例一致。
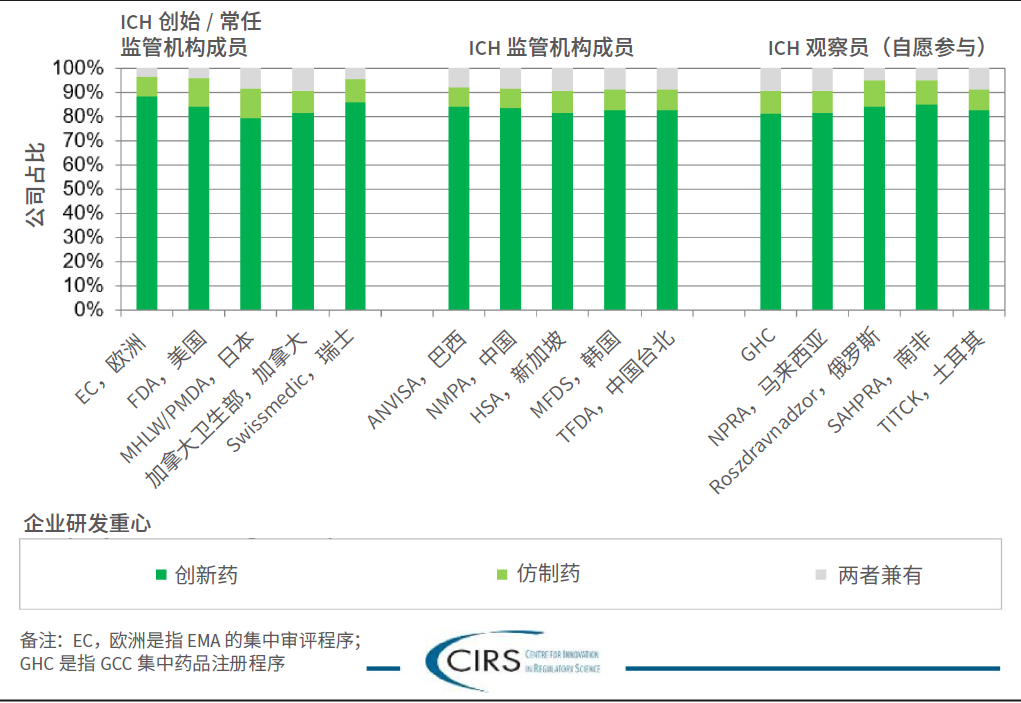
企业研发重心:请企业明确其药品研发的重点领域,例如创新和/ 或仿制药。
关键信息:约80% 的企业聚焦在创新药物研发。
点击【阅读原文】获取完整报告pdf
报告作者:
国际监管科学创新中心(CIRS)-www.cirsci.org
Magda Bujar, Manager, Strategic Developmen t
Neil McAuslane, Scientific Director
CIRS(国际监管科学创新中心)是科睿唯安旗下一家位于英国的独立运营分支机构,隶属于科睿唯安(英国)。CIRS 的使命是保持其在业界的权威领导地位,运用科学方法优化推进药品监管与卫生技术评估 (HTA) 的政策与流程。CIRS 为工业界、监管机构、HTA 和其他医疗利益相关者提供了一个国际平台,通过创新地应用监管科学开展会议、讨论及制定监管与补偿政策,从而促进药品的可及性。这正是CIRS 的目标。CIRS 致力于实现这一目标。该组织拥有独立的专职管理和顾问团队,运营资金来源于会费、相关活动、专业项目和基金资助。
ICH 指南执行的领导者
Jerry Stewart, Vice President, Global Regulatory Policy Head, Pfizer, representing PhRMA
Junko Sato, Office Director, Office of International Programs, MHLW/PMDA, Japan
人用药品注册技术要求国际协调会议(ICH) - www.ich.org; admin@ich.org
人用药品注册技术要求国际协调会议(ICH)联合监管机构与制药业讨论药物注册的科学和技术,ICH 在此过程中发挥了独一无二的作用。自1990 年成立以来,ICH 一直在不断发展,以应对日益全球化的药物开发。ICH 的使命是进一步实现全球法规协调统一,确保以最节约资源的方式研发和注册安全、有效、高质量的药物,从而促进公共健康事业发展。自2015 年10 月进行组织架构调整以来,ICH 作为一家独立、国际非盈利机构已逐步发展,现已拥有16 家成员单位和32 家观察单位。
致谢
特别感谢Petra Doerr 和Jerry Stewart 领导的ICH 执行委员会,及参与的制药企业、ICH 监管机构成员和观察员。
本报告中文版由科睿唯安翻译, 其英文原版由International Council for Harmonisation of Technical Requirements for
Pharmaceuticals for Human Use(ICH)和Center for Innovation in Regulatory Science(CIRS)
联合发布,且著作权属于 ICH。ICH的相关权利及声明请见其官网(https://www.ich.org/page/legal-mentions)
四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..