医谷最新消息,6月30日,据国家药监局药审中心(CDE)官网信息显示,张江科学城细胞治疗企业药明巨诺申报的瑞基仑赛注射液(暂定名)上市申请获国家药监局CDE承办,这是继复星凯特(同为张江科学城细胞治疗企业)申报的益基利仑赛注射液(国外商品名为Yescarta)之后,国内第二个递交上市申请的CAR-T疗法。值得一提的是,不同于益基利仑赛已在国外上市,药明巨诺此次申报的瑞基仑赛为全球首次申报上市。
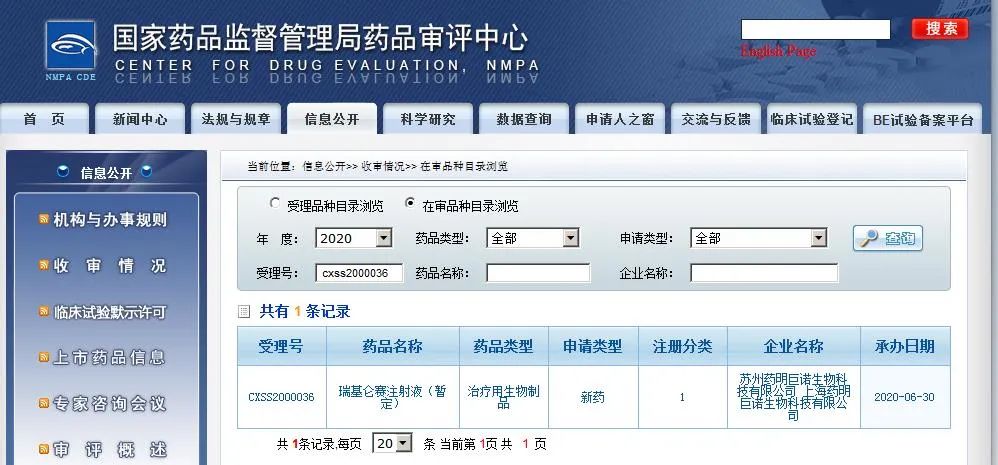
据了解,瑞基仑赛注射液(研发代号:JWCAR029)是在美国Juno公司JCAR017的基础上,由药明巨诺自主开发的CAR-T产品,于2017年12月通过明聚生物递交IND申请(新药临床试验申请),开展针对复发难治淋巴瘤和白血病治疗的临床研究,于2018年6月获得临床批准,这是国内当时首个获批临床以CD19为靶点的CAR-T产品。
2019年12月,在第61届美国血液病学会(ASH)年会上,药明巨诺公布了JWCAR029治疗成人复发/难治B细胞非霍奇金淋巴瘤(R/R B-NHL)的I期临床试验数据,在入组的32个病人、4个爬坡剂量的I期研究中,JWCAR029显示了良好的安全性和有效性。对于预后较差的R/R侵袭性B-NHL患者,输注JWCAR029可获得优异且持久的缓解,6个月时所有患者(n=29)的ORR为58.6%,CR率为55.2%;对所有回输剂量的DLBCL患者:ORR为45%,CR率为45%。安全性方面,JWCAR029毒性可控,未发生CRS或NT相关性死亡,3/4级CRS或NT发生率低,约为6% (n=32)。
截止目前,药明巨诺已建立了成熟稳定的工艺体系与国际领先的cGMP生产质量管理流程,其位于张江的研发中心也已于2018年12月落成,占地面积约2500平方米,专注于细胞治疗的创新性与实践性研究,力求解决细胞免疫疗法在基础研发、产业化生产工艺开发以及质量管理体系等方面的重大科学与应用问题。
就在本月初,药明巨诺宣布完成总额为1亿美元的B轮融资,本轮融资所募集资金就将主要用于持续推动JWCAR029的临床研究、进一步扩充研发管线和商业化准备以支持新产品上市。
文 | 医谷
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..