为指导和规范药物临床试验必备文件的保存,根据《药品管理法》《疫苗管理法》《药物临床试验质量管理规范》等相关法规要求,国家药品监督管理局组织制定了《药物临床试验必备文件保存指导原则》,现予发布,自2020年7月1日起施行。
特此通告。
药物临床试验必备文件保存指导原则
一、定义、基本要求与适用范围
药物临床试验必备文件是指评估药物临床试验实施和数据质量的文件,用于证明研究者、申办者和监查员在临床试验过程中遵守了《药物临床试验质量管理规范》和相关药物临床试验的法律法规要求。药物临床试验必备文件作为确认临床试验实施的真实性和所收集数据完整性的依据,是申办者稽查、药品监督管理部门检查临床试验的重要内容,应当符合《药物临床试验质量管理规范》中必备文件管理要求。本指导原则适用于为申请药品注册而进行药物临床试验的相关必备文件保存。
二、参考文献
ICH E6(R2) Guideline for good clinical practice
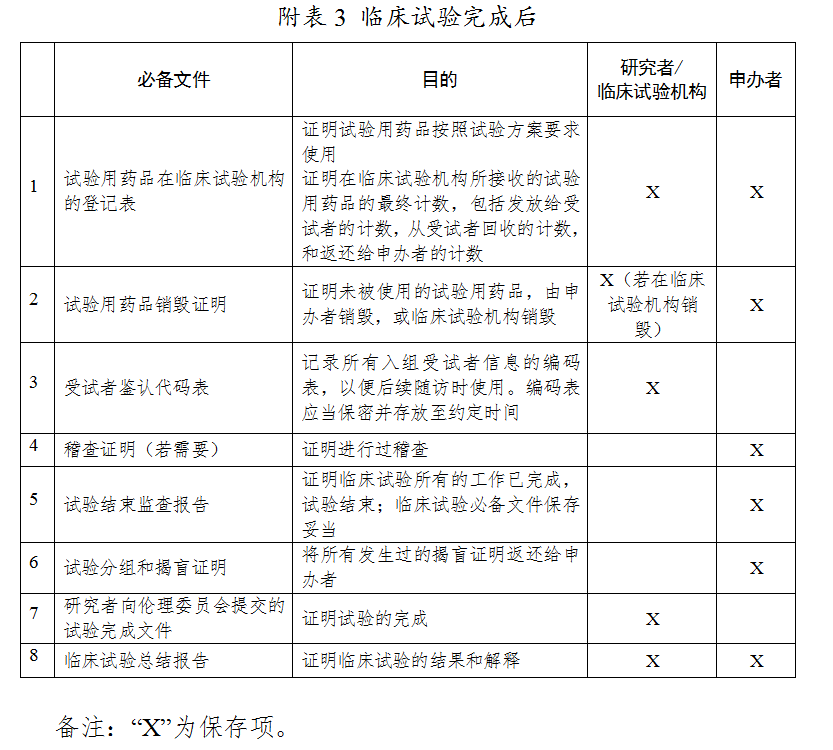
三、附表
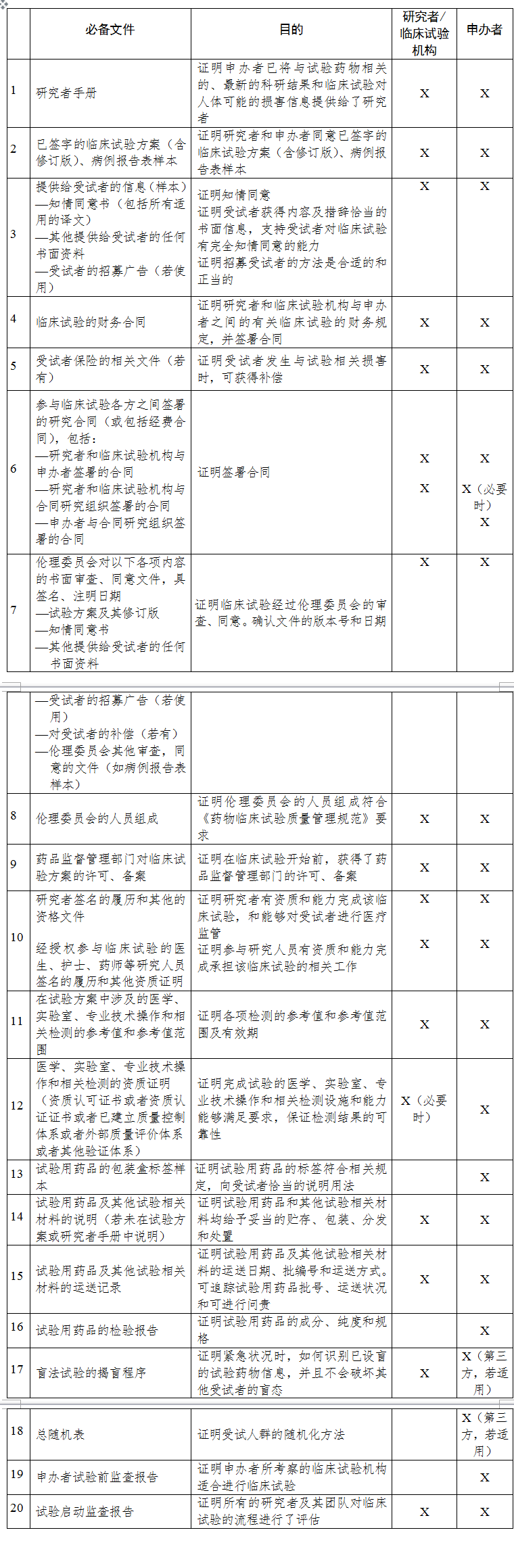
附表1 临床试验准备阶段

四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..