▎药明康德内容团队编辑
2019年8月,FDA推出罕见病治愈加速器计划,该平台目前开始转向支持罕见病临床试验,以期在现有的多个临床试验网络基础上,建立通用的罕见病临床试验网络平台,博采众长、更上层楼。
为进一步推进建立罕见病临床试验网络,FDA正向公众和利益攸关方征询建议、意见。FDA正在寻求提供一种更具合作性的方法,支持罕见疾病的药物开发管线。
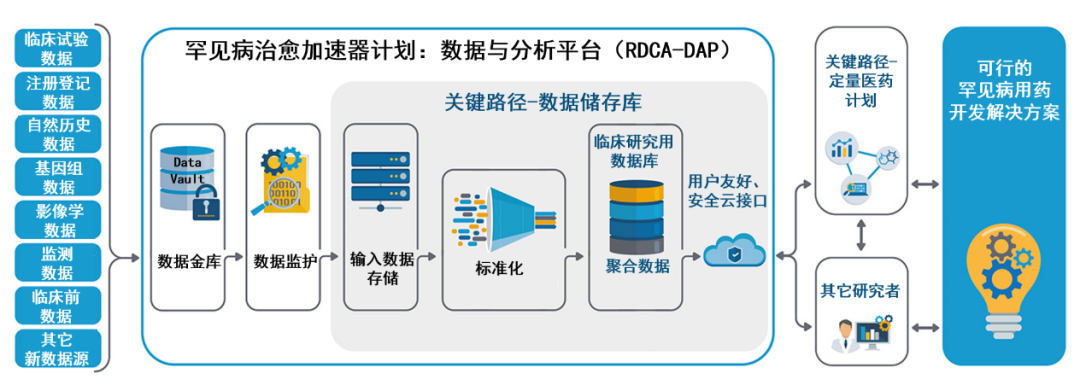
FDA目前正在推进罕见病治愈加速器计划(Rare Disease Cures Accelerator),用于支持罕见病药物研发管线创新与质量。这一加速器计划,将建立通用的平台和方法,用于支持罕见病表征、开发用于标准临床结局评价的核心数据集,以及确定罕见病相关终点,为在罕见病患者人群中开展临床试验提供支持。由美国国会拨款1000万美元启动的这项工作,始于2019年。该平台早期专注于罕见病标准和标准化数据方法方面;现在开始将重点转向支持罕见病临床试验。
数据来源:参考资料[5] (药明康德内容团队制图)
FDA表示有意了解目前正在开展的工作,以及需要开展哪些工作来解决其罕见病治愈加速器计划的第三个组成部分,提供可行的罕见病用药开发解决方案。
尽管罕见病人群规模小,但在全球范围内都存在罕见病,因此支持罕见病药物开发所需的网络平台,也将面向全球展开相关研究。FDA正就具体领域的发展向利益攸关方征询提出建议、意见,包括了解全球临床试验网络的短期和长期目标,以及如何构建这一网络。
该临床研究网络,需要确定不同学科的人员配备,制定临床试验所需的研究方案设计指南,以及患者数据保护标准规程的正确组合。FDA希望利益攸关方能够就这些领域提出具体的建议、意见。FDA还希望利益攸关方权衡,如何最好地利用与疾病无关的中心和专注于疾病的中心及相关服务;同时就相关网络的广度和所针对的特定疾病,提出建议和意见。

数据来源:参考资料[5] (药明康德内容团队制图)
FDA促请在全球临床试验网络成功治理模式方面富有经验的利益攸关方,分享他们的经验。同时,FDA正在了解,对于新的罕见病临床网络,现有网络能否发挥补充作用。这些现有网络,包括国立卫生研究院(NIH)资助的罕见病临床研究网络(Rare Diseases Clinical Research Network,RDRCN),国家癌症研究所(NCI)的实验治疗药物临床试验网络(Experimental Therapeutics Clinical Trials Network,ECTCN),以及欧洲药品管理局(EMA)的欧洲儿科研究网络(European Network of Paediatric Research,Enpr-EMA)。NIH资助的罕见病临床研究网络(RDRCN),目前有23个活跃的联合体参与合作。FDA同时希望利益攸关方能关注罕见病临床试验网络的其它方面,包括对基础设施的要求,建立和维持网络所需的必要资金投入,实施的关键里程碑和时间表,以及建立全球罕见病临床试验网络和维持网络运行所面临的挑战和障碍。
书面和电子版建议、意见征询截止日期为2020年7月30日。
四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..