随着医学研究和创新药物研发步伐的加快,这些药物的成功将给更多人带来希望,并且为开发者在提供创新机制和治愈潜力的同时带来经济效益。
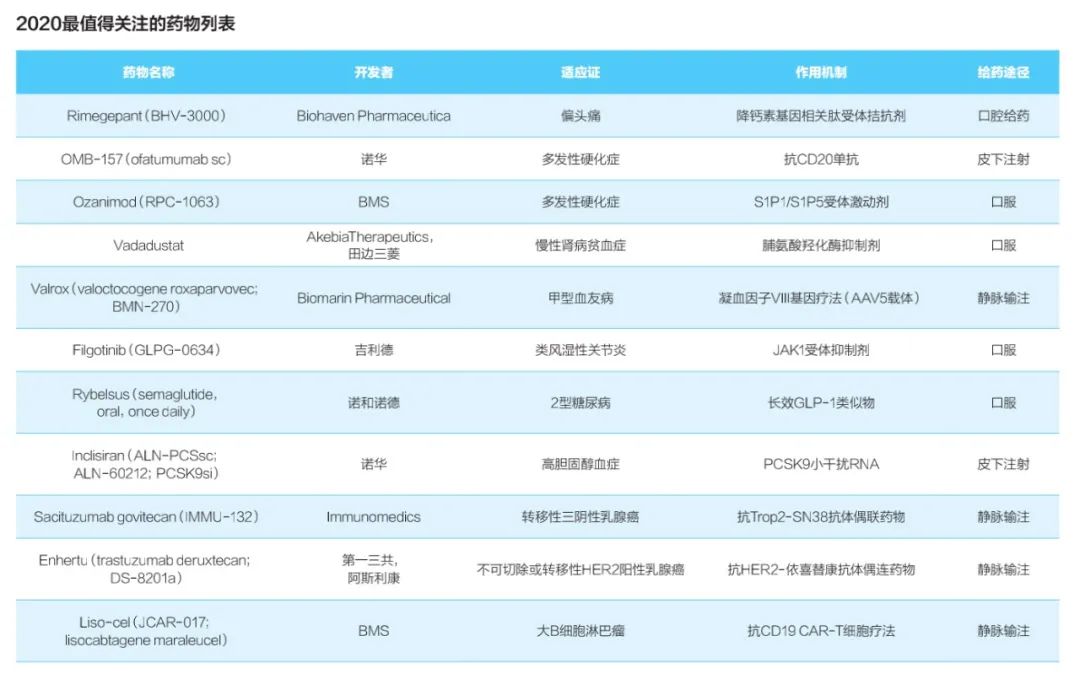
2020年2月,科睿唯安发布了《2020最值得关注的药物预测》年度报告,预测了11种将于2020年上市并且到2024年年销售额有望突破10亿美元的新药(重磅药物)。
科睿唯安从已在2020年初处于Ⅱ期或更高临床阶段的药物中甄选产生了一份潜力药物清单。团队分析师随后通过审查清单中每个药物的年度申报文件、管线信息、临床试验、专利情况、化学、交易记录、会议、企业公告以及法规状态等信息,逐一对入选药物进行专项研究和评估。
值得关注的药物主要集中在慢性、进展性疾病领域,包括针对乳腺癌、多发性硬化症(MS)、偏头痛和2型糖尿病的药物。
BioWorld新闻部主任林恩·约菲(Lynn Yoffee)说:“尽管科学创新、商业动机和公共利益之间有时存在冲突,但随着医学研究和创新药物研发步伐的加快,这些药物的成功将给更多人带来希望(如果负担得起),并且为开发者在提供创新机制和治愈潜力的同时带来经济效益。”
01 重磅炸弹和支付挑战
有望治愈重症甲型血友病的潜在基因疗法Valrox将成为有史以来最昂贵的药物,新名单上的11种新药有望在2024年底甚至更早就达成10亿美元以上的年销售额,这将进一步突显医疗创新和社会支付能力之间日益紧张的关系。在根本性分歧的推动下,支付方与制药行业间的冲突仍将持续。
由科睿唯安的Cortellis团队预测分析,这份名单上癌症治疗药物占大多数。几乎像达成共识一样地,这些药物的开发均获得了加速,要么是通过孤儿资格认定,要么是为促进药物监管机构与开发者之间更紧密合作以造福患者。这11种可能成为重磅炸弹的药物共拥有18个孤儿药资格认定,四个FDA突破性疗法认定,两个EU PRIME指定和一个日本SAKIGAKE指定。
入选Cortellis评估分析范畴的药物包括在2020年初就已进入Ⅱ期临床试验或者更后期,但排除2020年前就已上市的药物。根据研发公司预期的批准日期或上市日期,这些名单上未获批的药物有望在2020年获批上市。
名单上的大多数药物正在开发或即将进入的是已挤满竞争对手的适应证,这意味着它们将面临说明自己与众不同的巨大压力。预计多数进榜的药物将强调自己与其它疗法相比将提高安全性,特别是围绕心血管风险,还有一些则强调新的作用机制,甚至是治愈疾病的潜力。
Rybelsus(口服semaglutide)和Enhertu(曲妥珠单抗)这两种药物已获得美国监管部门的批准,每种都预示着独具意义的创新性,以证明它们对患者和支付方的潜在价值。来自诺和诺德的Rybelsus是首款针对2型糖尿病患者的口服胰高血糖素样肽1受体激动剂,以更为方便的每日一片的方式达到了迄今为止只能通过注射给药的疗效。第一三共和阿斯利康联合开发的Enhertu比预期提前了数月获批,为某些乳腺肿瘤提供了新的治疗方法,它的开发是建立在另一个重磅炸弹级药物赫赛汀之上,自1998年获批以来医学对这类疾病的认知及进展。
名单上半数以上的药物为生物制剂,这是处方药中一个快速增长且日益昂贵的领域,近年来监管部门和支付方采用了不同方法试图控制成本。基因疗法和细胞疗法,分别以甲型血友病治疗药物Valrox和大B细胞淋巴瘤治疗药物lisocabtagene maraleucel为代表,均因可能远超预算而备受关注,尤其是有2019年诺华获批的可用于罕见的遗传性疾病脊髓性肌萎缩症治疗的Zolgensma(onasemnogene abeparvovec)的先例,价格令人瞠目,批发采购价约为210万美元。
尽管欢迎创新的生物制剂,但监管部门还在鼓励生物类似物对同类老产品进行更充分的价格竞争(生物类似物是被公认的与已批准的原研生物制剂高度相似的药物)。这类挑战者可能会对今年上榜的一些在列药物构成不利影响,包括用于多发性硬化症的ozanimod(由BMS研发)及用于类风湿性关节炎的filgotinib(由Galapagos NV和吉利德联合研发)。
今年上榜的有11种药物,在数量上多于去年的7种,并且包含了更多的“first-in-class”药物。Biohaven制药的偏头痛药物(BHV-3000)有望成为首个用于急性偏头痛治疗的小分子CGRP拮抗剂。Valrox如果获批将成为治疗任何形式血友病的首个基因疗法。来自The Medicines的Inclisiran可能成为首个获批的基于siRNA的PCSK9抑制剂。Immunomedics公司的sacituzumab govitecan有望成为第一个靶向泛上皮癌抗原TROP-2的ADC药物。
回顾去年名单,作为去年名单上唯一的“first-in-class”药物Palforzia,它突显出每种药物进入市场路径微小差别的重要性,Aimmune制药的Palforzia直到2020年1月31日才获得批准,预计到2024年销售额才会超过10亿美元,比之前的预期晚一年。2019年同样上榜的其他药物也面临上市后的销售差异,如用于预防遗传性血管性水肿的Takhzyro(由武田制药研发)上市后面临销售停滞不前;同时间也有如甲型血友病的治疗药物Hemlibra(由罗氏研发)销售一路颷升。
02 重磅炸弹的定价
一个药品不管它多有效,如果需要的人买不起,那么它就是毫无价值的。这句话获得了参与美国国会药品价格听证会的患者和政策专家盛赞。
随着公众对这一问题的关注和审视越来越多,今年上榜的11种药物,其中一些市场表现可能会受到定价影响,尤其是那些进入拥挤治疗领域的品种,他们不仅将面临来自其他品牌药物的竞争,还将面临来自这些品牌药物的仿制药或生物类似物的竞争。
过去,市场竞争并不一定引发降价,至少在美国是这样,“许多经济学家可能认为,在日益拥挤的治疗领域中,药物将变得更便宜、更能负担得起,”临床和经济评论研究所首席科学官Pamela Bradt指出。相反,她说由于制药公司向药品福利管理机构(PBMs)支付处方规定的回扣,即使在类风湿性关节炎(RA)这样的治疗领域,“传统市场变化也已无法压低价格”。
在这样的回扣体系下,市场竞争影响了回扣支付方被迫与PBMs协商优先选择处方,而不是标价。在欧洲和其他市场上,竞争会影响与一些机构的谈判,如英国国家卫生和临床技术优化研究所(NICE),这些机构确定与现有药品相比,新药的价格是否能有效利用有限的医疗资源。
但目前美国的形势正在发生变化,因此,制药公司在上市新产品时,需要考虑那些新兴变化趋势。定价(或更确切地说是患者必须支付的费用)可以决定医生开出的是有效的老药还是更有效、更安全或者更方便的新药。随着许多美国议员敦促卫生与公众服务部就医疗支出最大的药品进行价格谈判,制药公司可能也想看看他们的定价将如何影响医药支出。
在糖尿病等大的治疗领域,这是一个重要因素,由于患者购买胰岛素的费用不断上涨,而且只有三家公司控制着这一巨大的市场,人们已经对此感到不满。诺和诺德就是其中之一,该公司凭借Rybelsus(口服索马鲁肽)入选了今年的名单。
根据ICER测算,Rybelsus每年在美国的实际价格预计为6103美元,作为2型糖尿病的辅助治疗是划算的。尽管如此,独立的非营利研究机构还是发布了一份关于该药可及性和可负担性的警告,理由是口服索马鲁肽的需求很高。过去,许多本来可以从GLP-1治疗中受益的患者因为需要注射而不想使用它,现在有了口服制剂,他们更有可能使用口服制剂。
因此,大量的需求可能会导致费用增加,“而卫生系统在不取代其他必要服务或不促进医疗保险费用快速增长的情况下,短期内难以吸收这些需求,这将威胁所有患者获得高价值医疗服务的可持续性。”ICER警告称。
在竞争激烈的类风湿性关节炎治疗领域,定价可能是吉利德filgotinib取得成功的关键,filgotinib是JAK1选择性抑制剂,正在等待获批。该治疗领域已由艾伯维的重磅炸弹修美乐(阿达木单抗)把持多年,修美乐现正与欧盟的几个生物类似物竞争市场,未来到2023年美国还有5个生物类似物上市。除了修美乐,类风湿性关节炎患者还可以选择其他治疗药物,包括另外三种JAK抑制剂。
在评估已获批的JAK抑制剂的成本效益时,ICER使用修美乐的价格与艾伯维的Rinvoq(upadacitinib),辉瑞的Xeljanz(tofacitinib)以及礼来的Olumiant(baricitinib)作比较。根据比较结果,ICER以价值为基准,判断Rinvoq的价格基准范围在44000美元到45000美元之间。ICER表示,这比Rinvoq每年59860美元的定价低25%,“我们认为这个折扣(25%)与制造商目前提供的回扣是一致的。”
上述对比可以为诸如filgotinib之类的新药提供定价指导,但他们并没有首先解决人们对新药价值的担忧,随着新药上市价格的持续攀升,这种担忧肯定会在患者和政策制定者中不断加剧。
Bradt表示,“尽管与修美乐相比,upadacitinib似乎达到了成本效益的正常门槛,但对于17年前推出的修美乐一开始的定价是否合理,仍存在疑问”。在过去的17年中,修美乐曾多次提价,所有这些都使它的重磅炸弹地位得到提高和巩固。
例如2017年至2018年间,修美乐的批发采购价增加了约19%,而其净价增加了近16%。ICER表示这一净价的变化导致药品支出增加了18.6亿美元。
偏头痛治疗是另一个出现在今年重磅炸弹名单上的治疗领域,它见证了竞争的加剧。Biohaven制药的rimegepant、礼来的Reyvow(lasmiditan)和艾尔建的
Ubrelvy(ubrogepant),似乎“总体上不如曲坦类药物有效,而且预计价格要贵得多,”ICER首席医学官David Rind说。但他又补充道,对于那些不能服用曲坦类药物或不能从曲坦类药物中获益的患者,rimegepant和其他两种药物对偏头痛症状的改善患者比安慰剂组多10%至20%。
根据ICER的一份证据报告,尽管曲坦类药物有望继续作为偏头痛的一线治疗药物,但考虑到曲坦类药物的常见副作用及禁忌症使得患者需要像rimegepant这样的替代药物。ICER还表示,要想提高成本效益,rimegepant的价格需要控制在每年2200美元至3200美元之间,远低于GSK的舒马曲坦。
但若要在未来几年达到重磅炸弹级别,rimegepant的定价可能需要更高。舒马曲坦在2007年顶峰时期的销售额也没能突破10亿美元大关。根据Cortellis分析,随着仿制药竞争全面展开,舒马曲坦2019年的销售额预计将仅为1.76亿美元。
今年所有上榜的产品中,Biomarin制药的甲型血友病基因疗法valrox如果获批,预计价格会最高,可能在200万美元至300万美元之间。由于valrox是一次性治疗药物,因此Biomarin制药与支付方达成的销售可能不如那些寻求针对慢性病高价药的公司多。
如果证明valrox是长期有效的,美国患者可以在五年内获得300万美元的一次性费用补偿,因为目前甲型血友病的其他治疗每年也要花费60万美元到80万美元。
然而,由于保险市场的不稳定性,支付方可能会对这种高价疗法望而却步,没有人能保证支付治疗费用的保险公司能意识到这是一种节约。因此,根据患者的年龄和其他因素,支付方可以在基因治疗的覆盖范围上附加很多条件。为了克服支付方的犹豫,Biomarin制药可能需在谈判中发挥创意,比如提供分期付款或者基于治疗结果收费等。
不论支付障碍多大,valrox每年即使只有不到500名患者也能取得巨大的销量。但接下来的问题是患者的共付费用。尽管制药公司指出,从“健康储蓄”的角度来看,一种治愈疗法能给患者带来价值证明了七位数的价格是合理的,但患者还是受到他们支付能力的限制。
03 血液疾病前景重塑
数以百万计的人患有血液系统疾病,随着人口老龄化,该类疾病的发病率预计还会增加。2019年FDA批准了好几种新疗法或拓展已批准疗法的新适应症用于非恶性血液病患者的治疗。这些疗法包括针对镰状细胞疾病的两种疾病缓解疗法(disease-modifying)和首次可治疗儿童静脉血栓栓塞的抗凝剂。
其中,两种潜在的重磅炸弹药物—用于甲型血友病治疗的Valrox(valoctocogene roxaparvovec)和慢性肾脏病相关性贫血的vadadustat则有望重塑血液系统疾病的治疗前景,到2024年预计将实现10亿美元年销售额。
Biomarin已向FDA提交了BLA(生物药上市许可申请),用于申请其针对甲型血友病成人患者的以腺相关病毒(adeno-associated virus,AAV)为载体的基因治疗药物Valrox上市。如果获得批准,Valrox将成为治疗甲型血友病的第一款具有治愈潜能的疗法,一次注射即消除了输血和FVIII替代疗法的需要。该公司预计待完成文件审查后,BLA审查将于今年2月启动。FDA已授予该疗法突破性疗法认定和孤儿药资格,EMA也已通过加速评审验证了公司的上市申请。
Cortellis的分析表明,如果获得批准,Valrox肯定会面临成熟的FVIII替代疗法以及即将上市的替代疗法的竞争。
去年全球甲型血友病的市场估计接近100亿美元,Bienaime在他的演讲中说:“估计有121000名患者属于公司覆盖的范围内。尽管该基因疗法的定价尚未确定,公司已经进行了大量付费者研究。他表示,付款人认为甲型血友病的生理矫正具有很高的价值,而且看来美国的付费者族群愿意接受200万美元至300万美元的价格。
Cortellis分析预测,今年Valrox的销售额将达到1745万美元,到2024年将增长至12.97亿美元。然而,尽管Biomarin凭借其基因疗法处于领先地位,但正在开发的FVIII基因疗法的潜在竞争者可能会削弱该公司中长期的预测销售额。
另一款产品Vadadustat,用于治疗慢性肾脏病贫血。贫血是慢性肾脏病(CKD)的许多并发症之一,随着肾脏疾病的进展而恶化;大多数CKD进展为肾衰竭的患者都患有严重贫血。据估计,全球CKD患者约有两亿人。
目前有几种缺氧诱导因子脯氨酰羟化酶(HIF-PH)抑制剂正在开发中,他们的目标市场是估值为35亿美元的肾性贫血市场。Akebia旗下的vadadustat已经进入晚期临床试验阶段。2019年7月,其战略合作伙伴三菱田边制药公司向日本厚生劳动省提交了新药申请,申请批准该产品用于CKD贫血的治疗。如果获得批准,该公司预计该药将在2020年中上市,并计划在美国和欧盟提交申请,这些地区将由Akebia与大冢制药联合销售。
在HIF-PH抑制剂本身这个类别中,特别是来自Fibrogen的Evrenzo(roxadustat)是vadadustat将面临的直接竞争者,该药物已于2019年第三季度在日本(透析患者)和中国(透析和非透析患者)获得上市批准。预计该药会在短期内完成第二项针对非透析患者的关键性研究,届时将在日本递交增加相关适应症的申请。分析表明,vadadustat还将面临来自CKD中其他公认疗法的竞争,例如静脉注射铁剂替代类产品和输血疗法,这些疗法可迅速增加Hb水平。未来的直接竞争也包括来自GSK的HIF-PH抑制剂daprodustat,该药已于去年8月在日本提交上市申请。
Cortellis分析引用了2024年的预测销售额,Evrenzo据估为11.88亿美元,daprodustat据估为为2.86亿美元。对于vadadustat,预计今年的销售额为200万美元,到2024年将增至15.89亿美元。
04 抗体偶联药物的时代来了吗?
入选今年重磅炸弹药物的三款肿瘤药中有两款是抗体偶联药物(antibody-drug conjugates,ADCs)。
自首个ADC药物获批以来,三年里只有四个项目进入市场。如何在安全性和疗效之间找到合适的平衡一直困扰开发人员。在《Drugs to Watch》重磅炸弹药物列表中列出的三种肿瘤药物中,有两种是ADC,其中一种已经获得了FDA批准。
2019年12月,阿斯利康和第一三共的Enhertu(fam-trastuzumab deruxtecan-nxki)获得FDA加速批准,该ADC项目比审评时限早了几个月获得批准,并于1月在美国上市。本品获批单药用于使用过两种或两种以上靶向HER2的治疗方案后不可切除或转移性HER2阳性乳腺癌。乳腺癌是全世界女性中最常见的癌症,每年新确诊患者约170万,其中4%至10%会发展成转移性,无法治愈的阶段。大约五分之一的乳腺癌患者是HER2阳性的,到目前为止还没有治愈方法。
Enhertu可能有广泛的应用前景,本品的胃癌适应证在日本获得先驱审查认定(Sakigake),预计第一三共将在日本提交上市申请。所有胃癌病例中有一半发生在东亚。两家公司于2019年3月签署了一项价值69亿美元的全球合作协议,第一三共制药拥有日本的独家权利,合作双方也在寻找其他市场注册机会。
Enhertu已进入赫赛汀和其他针对HER2的疗法(如Perjeta和Tykerb,拉帕替尼,GSK)主导的市场。阿斯利康表示,费用将因患者的体重而异,预计Enhertu的批发采购价为13265.6美元。根据《Drugs to Watch》分析,今年的销售预测为0.5亿美元,到2024年将增至20.2亿美元。
另外一款产品Sacituzumab govitecan是Immunomedics公司进展最快的候选药物,其为一种靶向Trop-2受体的ADC项目,Trop-2受体在许多实体癌中表达。本品可以将中等毒性药物SN-38直接递送至肿瘤组织。FDA授予本品突破性疗法认定,用于治疗已经接受过两种转移性疾病治疗的转移性三阴性乳腺癌(TNBC)患者。TNBC很常见,占乳腺癌的15%至20%。去年12月,FDA接受了重新提交的的BLA申请,寻求加快批准sacituzumab govitecan(IMMU-132)。依据优先审评,PDUFA的日期定为2020年6月2日。
根据《Drugs to Watch》的分析,本品前景可观。由于目前TNBC缺乏合适的靶向疗法,同时化疗效果一般,本品可能被广泛采用并成为TNBC的标准治疗。如果获得批准,预计今年的销售额将达到0.45亿美元,到2024年将急剧增长至12.7亿美元。为了帮助支付该项目的开发费用,Immunomedics在12月份的公开募股中筹集了约2.72亿美元,其净收益主要用于加速sacituzumab govitecan用于转移性TNBC适应证的美国商业化上市准备,同时扩展该候选药物的开发计划。
sacituzumab govitecan已经开始走向世界,Immunomedics和Everest Medicines起草了独家许可协议,许可sacituzumabgovitecan在大中华地区、韩国和某些东南亚国家开发,注册和商业化的权利。Everest Medicines是一家由C-Bridge资本支持的生物制药公司。
《Drugs to Watch》列表中的非ADC癌症药物是BMS的lisocabtagene maraleucel,也被称为liso-cel或JCAR-017。这是一款静脉注射的靶向CD19的CAR-T细胞疗法,针对大B细胞淋巴瘤,包括弥漫性大B细胞淋巴瘤(DLBCL),其为经过专门设计的T细胞,可以寻找并破坏表达CD19的癌细胞。
去年12月,BMS提交了一项BLA,用于治疗至少经过两次先前治疗的复发或难治性大B细胞淋巴瘤成年患者。吉利德的Yescarta(axicabtagene ciloleucel)是首个获批的治疗DLBCL的CAR-T疗法,于2017年10月获得了批准。2018年5月,诺华的Kymriah(tisagenlecleucel)获批用于进行了两次或更多次全身治疗后的复发性或难治性大B细胞淋巴瘤。
生产制造是CAR-T细胞疗法获得成功的最大障碍之一。白血病和淋巴瘤学会的首席科学官Lee Greenberger表示,由于liso-cel是T细胞的特殊混合物,因此在制造过程中纯化它们的任务将非常复杂。
Greenberger指出,liso-cel的响应率看起来与目前批准的两个产品相似,“但看起来更安全”。他补充说,需要注意的是,关于疗效和安全性,尚无做头对头的比较。而基于Liso-cel具有与其他细胞疗法相比的差异化特征,本品有潜力成为antiCD19项目中的同类最优(best-in-class)。
本文编辑节选自科睿唯安《2020最值得关注的药物预测》
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..