全球制药行业已踏入“生物制药创新的新时代”,并在不断开疆拓土,然而成功开发出能够给患者带来临床价值和获益的新药仍是一项艰巨的任务。研发失败的阴霾如影随形,但是药物研发企业艰辛的研发工作终有回报,得到了一些变革性的、在某些情况下甚至是治愈性的疗法。例如,细胞和基因疗法(cell and gene therapy, CGT)、CRISPR、CAR-T等相关研究,已经产生广泛影响。大量分布于生命科学各个新领域的研究论文和专利预示着科技发展将在产品开发方面哺育新的成功,给患者的健康带来更多利好,也给整个医疗健康系统带来众多改变。本文将对国外CGT领域的管线进行简述。
01
概况
据Signal Analytics公司统计,有超过3300项通过概念确证(PoC)阶段之后的细胞和基因疗法(CGT)临床试验,即II期至IV期临床试验,正在进行中,体现了对于这个前沿领域高涨的研发热情。这些临床试验针对的适应证主要为各类肿瘤和自体免疫疾病(图表1),针对遗传性罕见病如血友病、亨廷顿舞蹈症、镰状细胞病、脊髓侧索硬化症(ALS)等的临床试验则相对较少,然而针对这些疾病的其他类型治疗选择较少。CGT的形式包括干细胞疗法、基因疗法、CAR-T、病毒疗法、肿瘤浸润淋巴细胞(TIL)疗法、基于树突细胞的免疫疗法、TCR基因疗法等。
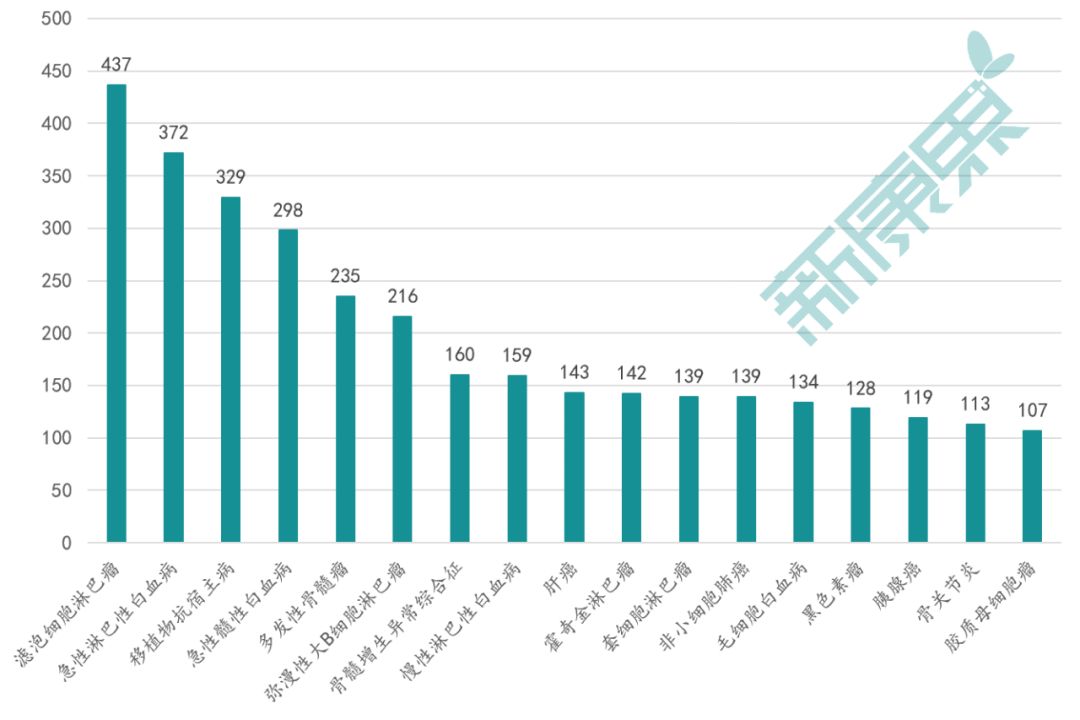
图表1. 正在进行的CGT临床试验按主要适应证分类排序
数据来源:Signal Analytics,中康产业资本研究中心
CGT领域的创新疗法都需要专利进行保护,不论是已进入临床阶段的还是处于临床前。在此领域也确实存在大量专利,其中科研院校和政府机构占了很大比例,在专利数量前15的机构中占据了9席。值得一提的是,中国的浙江大学以217个专利位于第14位,显示出中国在CGT领域的研发实力,这与业界普遍认为中国创新药将在生物技术领域实现弯道超车相互呼应。

图表2. 全球CGT领域相关专利的主要持有机构
数据来源:Signal Analytics,中康产业资本研究中心
02
管线简介
2019年9月初,英国国家健康与保健卓越研究所(NICE)推荐国家医疗服务体系(National Health Service)使用一款新的基因疗法治疗罕见遗传性眼病。2018年11月,诺华的一次性基因疗法Luxturna(voretigeneneparvovec)被欧盟委员会(EC)批准上市。该疗法用于治疗双拷贝RPE65基因突变引发遗传性视网膜营养不良而丧失视力,但是保留有足够数量的存活视网膜细胞的儿童和成人患者,可恢复和改善视力。该疗法成为在欧洲获批治疗遗传性视网膜疾病(IRD)的首个基因疗法。RPE65基因表达的酶可将全反式视黄酯转化为11-顺-视黄醛,进而合成视紫红质,维持视网膜色素再循环过程。当RPE65基因突变失去功能后,视网膜的光感受器因缺少视紫红质而不能对光发生反应,导致视力丧失。Luxturna为包含RPE65 DNA的重组腺相关病毒(AAV),经视网膜下腔注射,感染视网膜细胞,递送正确的RPE65基因,然后表达正确的蛋白,从而改善视力。

图表3. 基因疗法Luxturna的作用机理示意
来源:LUXTURNA官网,中康产业资本研究中心
在另一个前沿,Athersys将其专利MultiStem干细胞疗法用于治疗神经、炎性、免疫、心血管疾病等适应症。对于缺血性卒中,该公司执行了FDA特殊方案评估之下的III期关键性研究Master-2,并与Healios公司合作近期在日本开始了加速监管框架下的II/III期临床试验。MultiStem获得了日本PMDA(药品和医疗器械管理局)的优先审评资格认定。对于移植物抗宿主病(GVHD)和造血干细胞移植,一项特殊方案评估之下的III期关键性研究已经被美国FDA批准。该疗法被FDA和EMA(欧洲药品管理局)授予孤儿药资格认定,还被FDA授予快速通道(Fast Track)资格。
2019年8月,Arrowhead Pharmaceuticals和Janssen(杨森)开始一项关于不同组合疗法的IIb期研究,包括JNJ-3989(原ARO-HBV)或JNJ-6379,和一种核苷(酸)类似物,用于治疗慢性乙肝病毒(HBV)感染。JNJ-3989是一款在研的肝靶向抗病毒药,设计为皮下注射的治疗慢性HBV感染的RNA干扰(RNAi)疗法。JNJ-6379是一款口服的,针对组成常见衣壳结构的衣壳组装调节剂。
细胞和基因疗法(CGT)也被用于治疗经历持续性肺部感染的囊性纤维化(cystic fibrosis,CF)患者。在干细胞中使用基因编辑或许能够发现治愈性疗法。如果一个干细胞接受这类改造,那么这个干细胞产生的每个细胞也将有正确的基因。例如,如果一个气管干细胞有正确的囊性纤维化跨膜调节因子(CFTR)基因拷贝,由此干细胞产生的新肺细胞也将有正确的CFTR基因拷贝。研究发现可以使用囊性纤维化患者的细胞,应用基因编辑来纠正这些细胞中的CFTR突变,制造出诱导性多能干细胞(iPS),再将正确的细胞重新植入患者的肺部。
SelectaBiosciences公司准备将其免疫耐受技术(ImmTOR)平台与几种生物疗法联用于因高免疫原性而需要新治疗选择的罕见重疾。该公司的专有技术平台为合成疫苗粒子平台(synthetic vaccine particle platform, SVP),这是一种高度灵活的纳米颗粒平台,能够集成多种抗原和免疫调节剂,可用于改善或降低免疫系统对于给定抗原的反应。该公司的候选产品SEL-212正在被开发用于治疗顽固性慢性痛风患者,并解决他们的衰弱症状,包括耀斑和痛风性关节炎。
AbeonaTherapeutics公司的临床项目包括EB-101,一款用于隐性营养不良性大疱性表皮松解症的基因修正自体细胞疗法,以及分别用于黏多糖贮积症(MPS)IIIA和IIIB的基于AAV9的基因疗法ABO-102和ABO-101。
2019年8月,Orchard Therapeutics公司宣布将平衡现有的合同制造组织(CMO)网络和内部设施,创建商业化其基因疗法所需的基础设施。Orchard关于间接自体基因疗法的管线包括5款临床阶段项目,以及原GSK的造血干细胞基因疗法Strimvelis,该疗法于2016年被欧洲药品管理局(EMA)批准用于治疗腺苷脱氨酶缺乏症,一种导致免疫缺陷的常染色体隐形代谢紊乱。该疗法还在等待美国FDA的批准。
Alnylam公司正在将RNAi开发为一类新型药物。该公司的givosiran是一款用于治疗急性肝卟啉症(AHP)的N-乙酰半乳糖胺结合RNA干扰疗法(GalNac-siRNA)。AHP是一种罕见的遗传性疾病,由于血红素生成过程中代表性酶的缺陷,导致患者易在特定诱发因素下出现具有神经毒性的卟啉前体异常高水平蓄积而发病。2019年6月,公司完成了givosiran新药申请(NDA)的滚动提交。2019年8月,FDA接受了NDA并授予优先审评,预期于2020年2月给出结论。2019年11月,FDA提前3个多月批准该药上市,用于治疗患有AHP的成年患者,这使得givosiran成为继patisiran之后第二款获得FDA批准上市的RNAi新药。Givosiran每月皮下注射一次,靶向氨基乙酰丙酸合成酶1(ALAS1),可显著降低此酶的水平,从而将神经毒性血红素中间产物氨基酮戊酸ALA和PBG降低到接近正常水平,通过减少这些中间产物的积累来预防或减少卟啉症的发作。
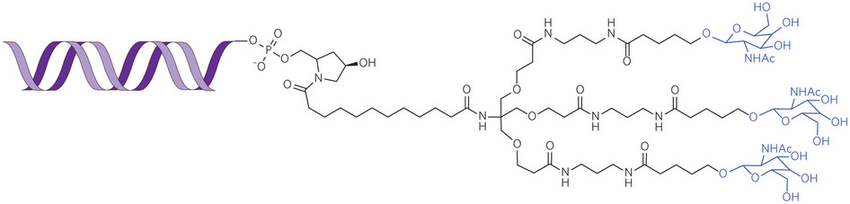
图表4. GalNac-siRNA的结构示意
来源:Alnylam官网,中康产业资本研究中心
在GalNac-siRNA类型的药物分子中,双链RNA与3个N-乙酰半乳糖胺(GalNac)连接起来。药物注射进入体内后,GalNac可以与肝脏表面的半乳糖特异性受体(ASGPR)结合,通过内吞进入细胞,由于ASGPR主要存在于肝细胞,也实现了肝靶向性。药物进入细胞后,GalNac与RNA分离,ASGPR重新回到肝细胞表面。双链RNA中的反义链与RISC蛋白形成复合体,将目标靶点蛋白的mRNA分解掉,从而使mRNA对应的目标蛋白不能生成。

图表5. GalNac-siRNA的作用机理示意
来源:Alnylam官网,中康产业资本研究中心
03
并购活动
在以细胞基因疗法(CGT)领域为中心的,值得注意的工业交易中,拜耳(Bayer)于2019年8月收购了BlueRock Therapeutics公司来建立拜耳的细胞疗法管线。继2016年与Versant Ventures合资成立BlueRock Therapeutics后,拜耳将通过在交割时支付约2.4亿美元现金的首付款,并在达到预定的开发里程碑后再支付3.6亿美元的方式收购剩余股份。如考虑拜耳目前持有该公司40.8%的股份,该项投资的价值相当于BlueRock Therapeutics公司的总市值,约为10亿美元。BlueRock使用专有的诱导多能干细胞(iPS)平台“Cell+Gene”来开发用于神经病学、心脏病学和免疫学的细胞疗法。一项用于治疗帕金森病的先导项目预计在2019年底进入临床试验阶段。
04
关注价格
2019年5月,美国FDA批准诺华(Novartis)用于一次性治疗脊髓型肌萎缩症(SMA)的基因疗法Zolgensma(onasemnogeneabeparvovecxioi),五年总费用定价212.5万美元,折合人民币约1468.8万元,成为制药史上单价最贵药物。SMA是由SMN1基因突变引起的,该突变阻断了运动神经元存活蛋白(SMN)的产生,而SMN蛋白是大脑向肌肉传递运动信号所必需的蛋白。患者主要为婴儿和儿童,不仅表现为肌肉无力和消瘦,通常还存在运动、呼吸和吞咽障碍等,且年龄越小致死率越高。Zolgensma通过单次静脉注射,提供SMN基因的功能副本,持续表达SMN蛋白表达来阻止疾病的进展,从根源上解决SMA。Zolgensma是FDA批准的首个也是唯一治疗SMA的基因疗法,包括那些诊断为未出现症状的患者。该药上市后引发舆论热议,患者家庭认为这是在以患者生命为要挟漫天收费。笔者认为高定价或可理解,这是由该药的特殊性所决定,该药针对存量市场空间本就有限的罕见病SMA,一次性治愈将会导致存量市场逐渐萎缩,而增量市场因发病率极低又很有限,为平衡高额研发成本才制定高价。此外,一次性高价药费与长期服用慢病用药相比,其实花费相近,但带来更高的生活质量。
随细胞基因疗法不断增长的影响力和对于其价格的关注,健康保险巨头Cigna引入了一项旨在保护参保组织免受再生医学疗法高价阻碍的计划。该计划将以治疗遗传性视网膜疾病(IRD)的Luxturna,以及诺华治疗2岁以下儿童脊髓型肌萎缩症(SMA)的Zolgensma开始。Cigna的Embarc Benefit Protection项目旨在消除与此类疗法花费相关的现金支付。采用Embarc的健康计划将按每人每月支付费用来加入一个基因疗法网络。医师将向保险公司提交这些药物的事先授权申请,一旦获准后,病人将不需自付药费。
2019年6月上市后,Zolgensma在2019年的销售额达到了3.61亿美元,其中第三季度1.6亿美元,第四季度增长到2.01亿美元。该药对于参加医疗救助(Medicaid)人群覆盖率在2019年底高于50%,仍有增长空间。2019年底对新生儿的筛查率仅有39%,如能进一步提高筛查率,或可提供增量市场空间。该药在欧洲和日本也已提交上市申请,预计分别于2020年1季度和上半年获批,在瑞士、加拿大和澳大利亚的上市申请预计于2020年下半年或2021年给出结论。综上,Zolgensma的增长空间不容小觑。

图表6. 诺华公布的Zelgensma的市场覆盖、销售及审批概况
来源:Novartis官网,中康产业资本研究中心
05
结语
囿于篇幅,行文至此。在本篇,我们介绍了细胞和基因疗法这个新兴领域在2019年取得的一些进展,主要为针对于临床需求迫切、社会关注度较高的罕见病用药。这些疗法包括腺相关病毒(AAV)载体基因疗法、诱导性多能干细胞(iPS)疗法、RNA干扰疗法(RNAi)等,这些疗法给一些罕见病治疗带来了重大突破,彰显了创新的魅力。同时,如何平衡研发成本、产品价格、患者经济负担也凸显出来,政府、保险需发挥相应作用,使创新药的研发成果能否切实惠及广大患者。
在后续篇章中,笔者会继续讨论其他5个领域,即CRISPR、心血管疾病治疗领域、CAR-T的改进、阿片替代,以及阿尔兹海默病疗法。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..