▎药明康德/报道
“枪挑”耐药性!第四代EGFR酪氨酸激酶抑制剂递交IND申请
药明康德合作伙伴Bridge Biotherapeutics公司宣布,该公司已经向美国FDA和韩国食品药品安全部(Ministry of Food and Drug Safety, MFDS)递交IND申请,申请启动检验BBT-176的1/2期临床研究。BBT-176是一款肺癌靶向在研疗法。
BBT-176是一款创新EGFR酪氨酸激酶抑制剂(TKI),它的设计旨在抑制携带C797S突变的EGFR。在携带包括C797S在内的三重突变(Del19/T790M/C797S,和L858R/T790M/C797S)的异种移植动物模型中,BBT-176表现出强力的抗癌活性。而且,BBT-176与抗EGFR抗体联用,表现出显著增强的活性。
该公司计划明年在韩国的晚期NSCLC患者中启动剂量递增研究,然后在韩国和美国进行进一步临床研究。1/2期临床研究将观察BBT-176的安全性、耐受性和疗效。
连下三城!口服糖尿病疗法关键性3期试验数据亮眼
Poxel SA与日本住友制药(Sumitomo Dainippon Pharma)公司联合宣布,其糖尿病创新疗法imeglimin,在治疗2型糖尿病患者的3期临床试验TIMES 2中,达到主要疗效终点。迄今为止,imeglimin已经在三项关键性3期试验中达到主要终点,成功地完成了TIMES临床开发计划。Poxel公司表示,他们计划在2020年向日本的监管机构递交imeglimin的上市申请。
Poxel公司开发的imeglimin是全球首款glimin类药物。它具有全新的作用机制。Poxel的科学家们认为,线粒体功能失调是糖尿病的原因之一,imeglimin通过改善线粒体的生物能学(mitochondrial bioenegetics),有望逆转这一疾病的潜在根源。这款药物能作用于肝脏、肌肉以及胰腺三大主要器官,有望促进胰岛素分泌,增加胰岛素敏感性,并抑制糖异生。综合起来,这有望带来降血糖的临床效果。此外,Poxel的公开资料还指出,imeglimin还有潜力为心血管和胰岛β细胞带来保护作用。
名为TIME 2的临床试验旨在评估imeglimin作为单药疗法,或与目前已获批的多款降糖疗法联用(包括DPP-4抑制剂、SGLT2抑制剂、GLP-1受体激动剂、双胍类药物等等),治疗2型糖尿病患者的疗效与安全性。试验结果表明,无论imeglimin作为单药疗法,还是与其它降糖疗法联合,都能使患者的糖化血红蛋白(HbA1c)水平得到显著降低。值得一提的是,在imeglimin与DPP-4抑制剂联合治疗的患者亚组中观察到,该组患者的HbA1c水平较基线时降低0.92%,是多种联合疗法中表现最为优异的疗法。
此外,患者的空腹血糖(FPG)水平与HbA1c水平的下降保持一致,但在imeglimin与GLP-1抑制剂联合治疗的患者亚组中的表现更为明显。该试验的完整数据预计在2020年的科学会议上公布。
里程碑!FDA批准首款口服CGRP受体拮抗剂Ubrelvy
美国FDA宣布,批准艾尔建(Allergan)公司开发的降钙素基因相关肽(CGRP)受体拮抗剂Ubrelvy(ubrogepant)上市,用于急性治疗偏头痛。这是FDA批准的第一款口服CGRP受体拮抗剂,代表着治疗这一顽疾的新药物类型。
开发CGRP受体抑制剂的药物研发历程并非一帆风顺,最初开发的小分子CGRP受体拮抗剂虽然在缓解头痛方面产生效果,但是长期使用它们带来的肝脏毒性让研发进程一度中止。另一方面,靶向CGRP受体或CGRP本身的抗体类疗法的研发获得了成功。这些抗体由于半衰期很长,可以每月,甚至每三个月一次注射就能够有效减少患者的偏头痛的发作次数。目前已经有3款抗体类药物获得FDA的批准。包括:诺华(Novartis)和安进(Amgen)共同开发的Aimovig(erenumab-aooe)、梯瓦(Teva)的Ajovy(fremanezumab-vfrm),以及礼来(Eli Lilly)的Emgality(galcanezumab-gnlm)
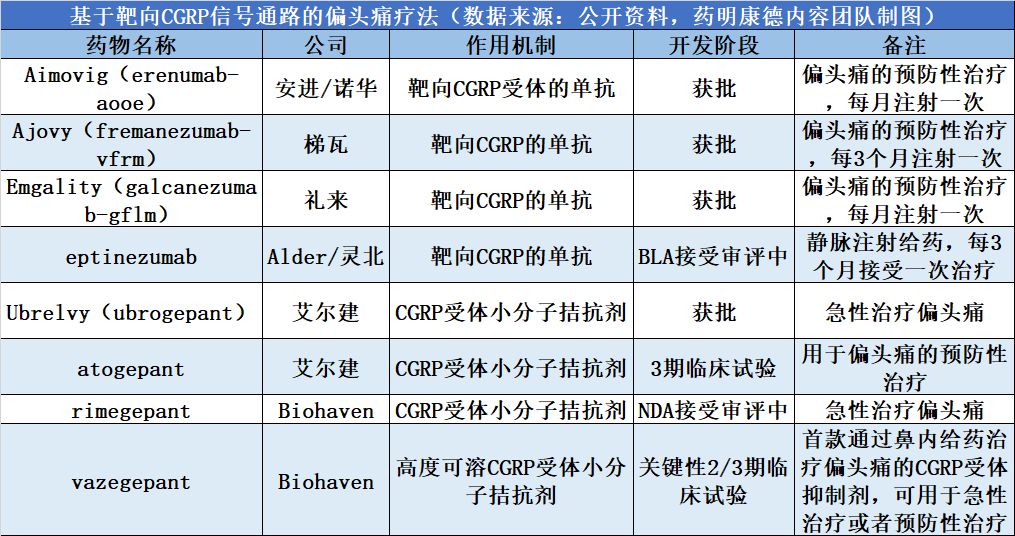
艾尔建公司开发的Ubrelvy是一款新一代小分子CGRP受体拮抗剂,它的结构不同于上一代小分子拮抗剂,有效地解决了肝脏毒性的问题。它的疗效已经在两项总计包含1439名偏头痛患者的随机双盲,含安慰剂对照的临床试验中得到验证。在两项试验中,接受Ubrelvy治疗的患者在接受治疗后两小时内达到无痛和其它偏头痛主要症状消失的比例都显著优于安慰剂组。
史上最大基因疗法授权许可!罗氏28.5亿美元斩获DMD基因疗法
罗氏(Roche)和Sarepta Therapeutics公司共同宣布,双方达成许可授权协议,罗氏将获得治疗杜氏肌营养不良症(DMD)的基因疗法SRP-9001在美国以外地区的独家推广权益。Sarepta将总计获得11.5亿美元前期付款(包括7.5亿美元现金和4亿美元股权投资)和潜在17亿美元的里程碑付款。根据Vantage的报道,这是迄今为止,细胞和基因疗法领域针对一个在研项目的最大授权许可。
Sarepta公司的SRP-9001是一款使用从非人灵长类动物中分离的AAVrh74载体的基因疗法。这一AAV载体的优势是能够在肌肉中引起转基因的强力表达,不会穿过血脑屏障进入中枢神经系统。而且,较少患者体内存在针对这一病毒载体的免疫力。SRP-9001基因疗法由MHCK7启动子驱动转基因的表达。这款启动子不但能够在骨骼肌、心肌和膈肌中驱动转基因表达,而且尤其增强了转基因在心脏中的表达。
▲AAVrh74病毒载体(图片来源:Sarepta公司官网)
2018年公布的早期临床试验数据表明,在最初接受治疗的4名DMD患者中,SRP-9001基因疗法不但表现出良好的安全性,而且在所有患者中都能够驱动微抗肌萎缩蛋白的表达,其平均值达到正常水平的74.3%。与之相比,近日获批的Vyondys 53疗法只将抗肌萎缩蛋白水平提高到正常值的1%。虽然两者表达的蛋白类型不一样(Vyondys 53疗法表达的蛋白更接近功能完整的全长抗肌萎缩蛋白),但是SRP-9001能够驱动高水平的抗肌萎缩蛋白无疑是一个好兆头。而且,初步试验结果表明,所有患者的的运动功能评分与基线相比也显示出了明显的功能性改善。目前,SRP-9001正在1/2期临床试验中接受检验。
靶向“氧感知通路”!罗沙司他在美国递交新药申请
药明康德合作伙伴珐博进(FibroGen)公司宣布,已经向美国FDA递交了该公司与安斯泰来(Astellas)和阿斯利康(AstraZeneca)联合开发的“first-in-class“低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI)罗沙司他(roxadustat)的新药申请(NDA),治疗因慢性肾病而引起贫血的透析/非透析患者。此前,roxadustat已经在中国获批上市,治疗因慢性肾病而引起贫血的患者。值得一提的是,该药的靶点“氧感知通路”在今年10月刚刚获得诺贝尔奖。
Roxadustat是治疗肾性贫血的口服小分子低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI)。低氧诱导因子(HIF)的生理作用不仅使红细胞生成素表达增加,也能使红细胞生成素受体以及促进铁吸收和循环的蛋白表达增加。Roxadustat通过模拟脯氨酰羟化酶(PH)的底物之一酮戊二酸来抑制PH酶,影响PH酶在维持HIF生成和降解速率平衡方面的作用,从而达到纠正贫血的目的。
该项新药申请的递交是基于包含15项临床试验的3期临床开发项目的积极结果,该项目在全球范围内共招募了1万多名患者。此前,《新英格兰医学杂志》(NEJM)曾公布roxadustat在两项3期临床试验中取得的积极结果。试验结果表明,与标准疗法阿法依泊汀相比,roxadustat对透析患者的临床获益和副作用没有显著差别。对于未接受透析治疗的肾性贫血患者而言,roxadustat可以使患者获得显著的临床疗效,有效纠正和维持肾性贫血患者血红蛋白水平。另外,珐博进此前还公布了roxadustat在其它5项3期试验中的积极结果。这些数据表明roxadustat与目前标准疗法相比,能够为透析依赖型和非依赖型CDK患者带来临床益处。
进军FDA!首款血友病基因疗法在美国递交上市申请
BioMarin Pharmaceutical公司宣布,已向美国FDA递交了其基因疗法valoctocogene roxaparvovec的生物制品许可申请(BLA),治疗A型血友病成年患者。BioMarin预计对这一BLA的审评将在2020年2月开始。新闻稿指出,这是美国FDA受理的第一份血友病基因疗法上市申请。今年11月,BioMarin刚刚向欧洲药品管理局(EMA)递交valoctocogene roxaparvovec的上市许可申请(MAA)。
Valoctocogene roxaparvovec是一种使用AAV5病毒载体递送表达因子VIII的转基因的基因疗法。它的优势在于患者可能只需要接受一次治疗,肝细胞就可以持续表达因子VIII,从而不再需要长期接受预防性凝血因子注射。该疗法已经获得美国FDA授予的突破性疗法认定和欧盟授予的PRIME药品认定,以及EMA和FDA授予的孤儿药资格。

▲接受不同剂量基因疗法治疗的A型血友病患者ABR数据(图片来源:BioMarin公司官网)
这一申请是基于正在进行的3期临床试验的中期数据分析,以及1/2期临床试验的最新3年疗效数据。在国际血栓和止血学会2019年会(ISTH2019)上公布的最新数据显示,在1/2期临床试验中接受一次剂量为6e13 vg/kg的基因疗法治疗的患者,在接受治疗后第三年,年出血率(ABR)和使用因子VIII的需求继续得到控制。在接受治疗的3年过程中,ABR和因子VIII使用率都平均下降96%。患者不再需要预防性因子VIII注射。
豪掷2.5亿美元开发泛JAK抑制剂!辉瑞联手Theravance
辉瑞(Pfizer)和Theravance Biopharma公司联合宣布,双方就局部泛JAK抑制剂的开发达成一项全球许可协议。该合作项目的主要目的在于开发出可在皮肤局部使用的泛JAK抑制剂,旨在靶向促炎途径,可快速代谢,并降低毒副作用。
Theravance的局部泛JAK抑制剂平台旨在开发可局部使用的治疗药物。这种开发策略与传统的系统性疗法相比,不但限制了药物全身暴露的毒性,还在可能提高剂量的同时,最大程度地提高患者的临床受益和用药安全性。

▲Theravance开发的局部疗法可在降低毒性的同时,使患者的受益最大化(图片来源:Theravance官网)
根据协议条款,Theravance将获得1000万美元的预付款,并且有资格从辉瑞公司获得高达2.4亿美元的开发和销售里程碑付款。此外,Theravance还有资格获得就本次合作研发的药物在未来的销售额分成。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..