常规审批通常需要完整的I-III期临床试验来全面衡量评估药物的预期临床获益和安全性,且该临床试验过程是属于新药研发过程中耗时最长(平均6-7年)、成本最高(约占总费用67%)的阶段,对于一些慢性进展性疾病以及潜伏期较长的疾病来说更是如此。
而加速审批是适用于治疗严重疾病并且解决未满足的医疗需求的药品通过评价替代终点或中间终点来提前获批上市,不必完成3期临床试验,基于II期临床试验结果申请上市。当然加速审批上市之后还需要做III期验证性试验,以进一步明确替代终点与临床终点之间的相关性。
用于加速审批的替代终点是“一种预测临床终点的生物标志物”,典型的比如在肿瘤药物治疗中,可以用客观缓解率(ORR)和无进展生存期(PFS)替代总生存期(OS)数据而提前上市。
FDA要求使用加速审批途径需要满足三个条件,一是用于治疗严重疾病,二是相对于现有疗法具有显着优势,三是显示具有改善替代终点或临床终点。并且申请人应在新药研发过程中与FDA审评人员保持沟通,探讨可否应用替代终点指标,以及验证性临床试验开展等有关问题。FDA对于企业提出的加速审批申请的回应时限并无明确规定。
经过加速审批途径上市的药物目前有多少个,分别是用于哪些适应症?采用了哪些替代终点,上市后验证性试验结果如何?是否有验证未通过而被撤销的品种呢?
本文将围绕这些问题分为三部分进行回答。所有数据是通过 FDA官网与Drugs@FDA数据库查阅、收集FDA加速审批药物信息。
一、FDA历年来以替代终点加速审批的所有药物
自1992年开始,FDA以加速审批途径批准的药物(包括新增适应症)共计198个。若按照药物分类(见图1)来说,其中化药居多,共有144个,占比72.7%;而生物药共有54个,占比27.3%,且近五年获批数量增多。
若按照申请适应症(见图2)来分类,排名前三位的适应症共占81.3%,分别是肿瘤119个(60.10%),HIV感染 30个(15.15%),吸入性炭疽 (暴露后)11个(5.55%)。其中HIV感染药物ZALCITABINE开启了FDA加速审批程序,在之后的十多年每年均会有HIV感染药物通过加速审批提前上市,直至2008年最后一个HIV药物ETRAVIRINE结束。
这段时期也正是人类抗艾药物发现的黄金时期。随着疾病谱的变迁,肿瘤治疗药物严重未满足临床需求,所以人们的目光更加聚焦于肿瘤药物的研发,这也势必会带来更多的药物会通过加速审批程序批准上市,尤其是近五年肿瘤药物占比持续居高不下(90.91 % VS 63.63% VS 70% VS 85.71% VS 83.33%)。
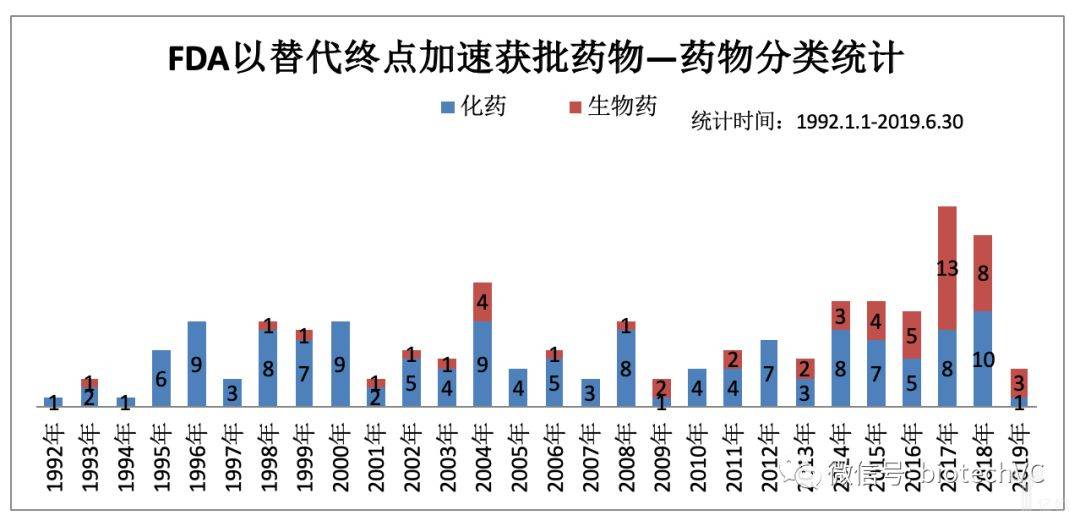
图1 药物分类统计
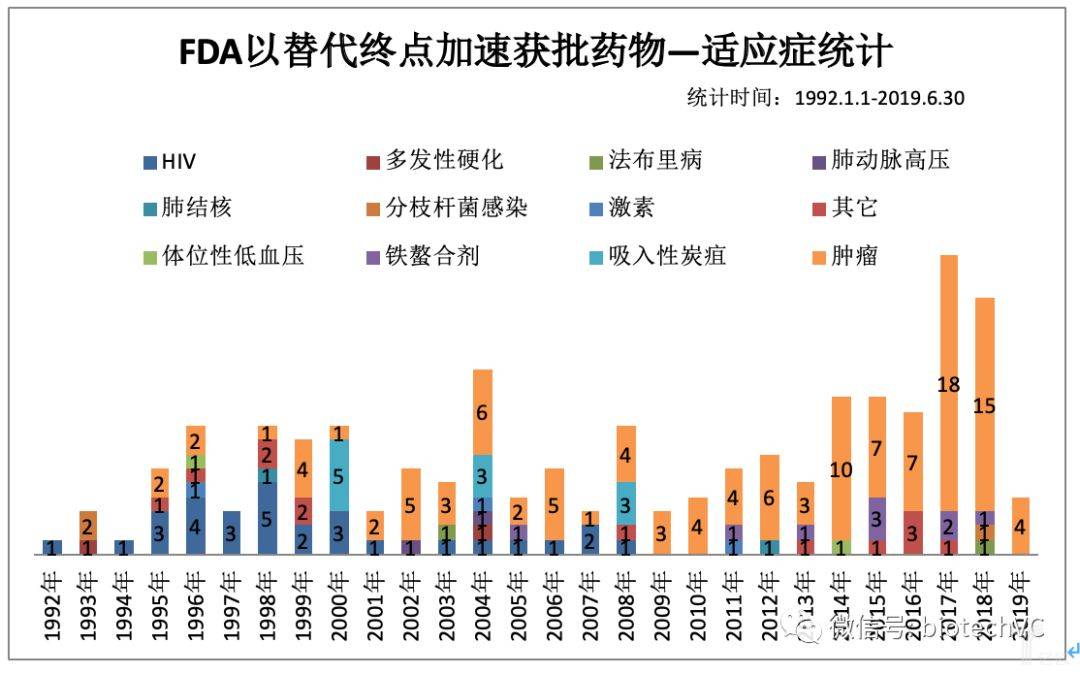
图2 适应症分类统计
备注:其它是指1例下述适应症:高铁血红蛋白血症,亨特综合征,肌营养不良症,家族性腺瘤性息肉病,抗凝逆转剂,克罗恩病,美洲锥虫病,耐万古霉素肠球菌(VREF)的治疗,烧伤后创面感染,心肌病,血小板减少症,原发性胆管炎,细胞保护剂。
二、FDA历年来以替代终点加速审批的肿瘤药物
既然通过替代终点加速获批的药物是以肿瘤药物为主,这也是所有药物研发企业布局的关键领域,那么我们现在来重点分析下。
首先,按照药物分类(见图3)统计,经加速批准的肿瘤药物中化药有71个(59.66%),生物药是有48个(40.34%),相比所有经加速获批药物来说,生物药占比有提高,尤其是近五年生物药加速获批比例反超化药,这与目前生物药研发现状相一致。
其次,若按照获批药物是否首次获批(NME或新增适应症)来分类(见图4),NME共有65个(54.62%),新增适应症共有54个(45.38%),也是近五年有更多的上市药物通过补充新适应症获得加速审批,其中KEYTRUDA在2014年9月4日以ORR替代终点首次加速审批之后,之后有12次是通过替代终点申请新适应症加速审批;同样,OPDIVO在2014年12月22日以ORR替代终点首次加速审批之后,还有9次也是通过替代终点申请新适应症加速审批。
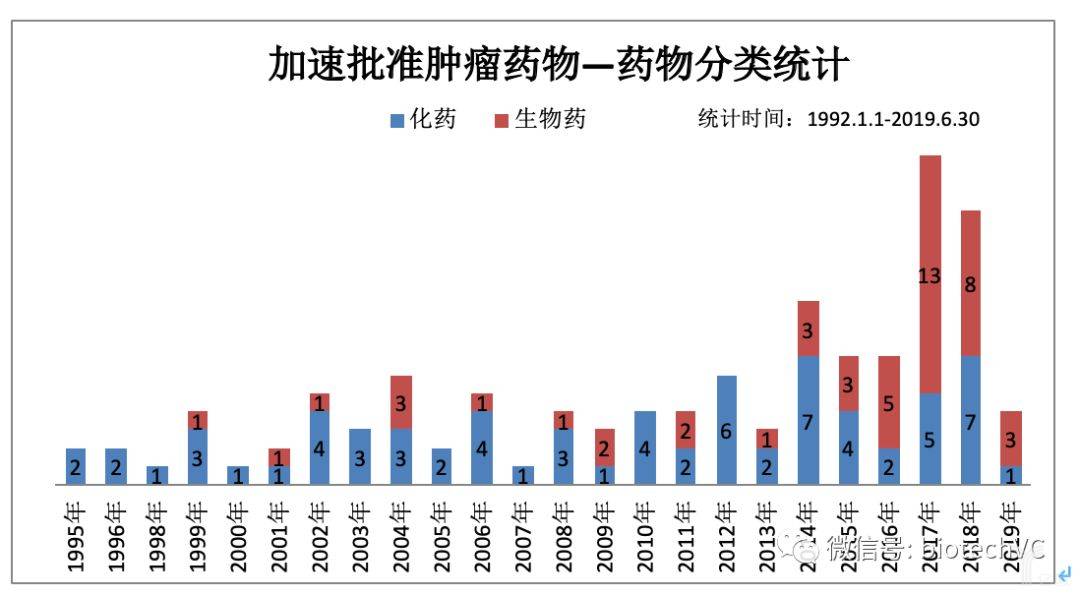
图3 肿瘤药物分类统计
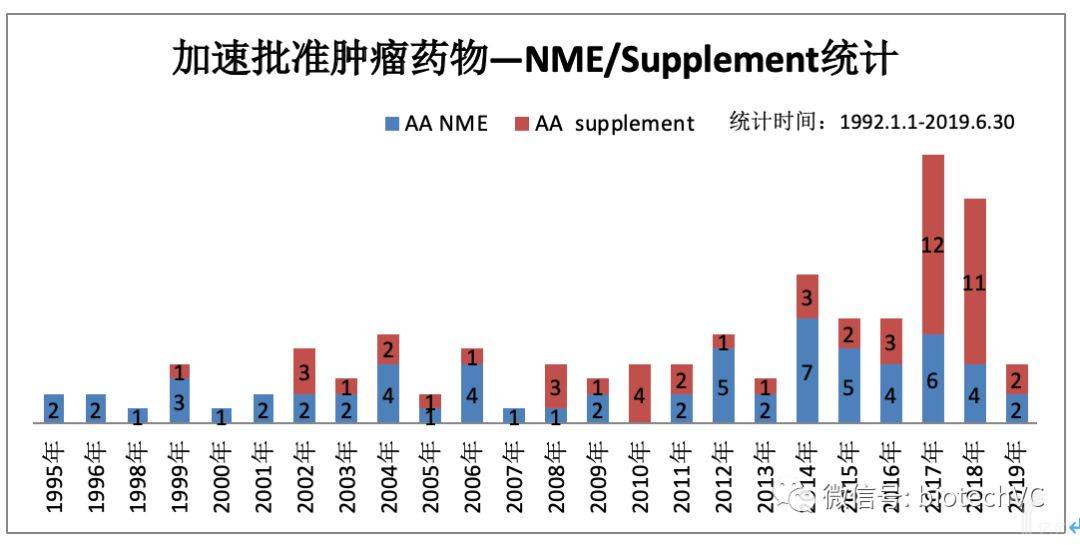
图4 肿瘤药物NME/Supplement分类统计
再次,若按照加速审批替代终点(见图5)来分类,其中以ORR替代终点获批的药物是103个(86.55%),其余替代终点包括PFS 11个(9.24%),DFS 3个(2.52%),OS和TTP各1个(0.84%)。由此可以看出,ORR是加速审批中最常用的替代终点。
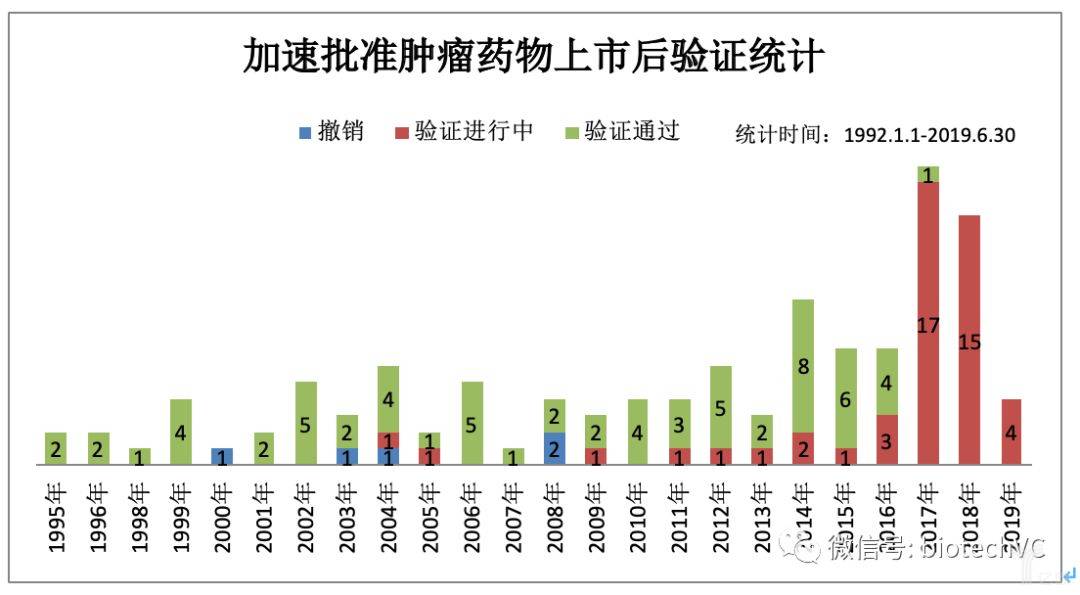
图5 肿瘤药物替代终点分类统计
第四,经过加速审批的药物在上市后需要做临床验证性试验来证明其临床获益。上述119个肿瘤药物截至统计时间段(见图6),已经完成验证的药物是71个(59.66%),其中包括验证临床获益的药物是66个,另外有5个药物在三期临床验证性试验中没有证明其临床获益,所以该适应症被撤销。剩余48个(40.34%)药物目前还处于临床进行中,验证结果未知,主要集中于2016年-2019年加速批准上市的药物。其中2004年,2005年,2009年各有1个加速审批药物依然处于临床验证试验中,大致推测该试验获益可能性较小,对于该种情况监管部门和临床用药需加以重视,以避免患者可能没有得到有效及时的治疗。
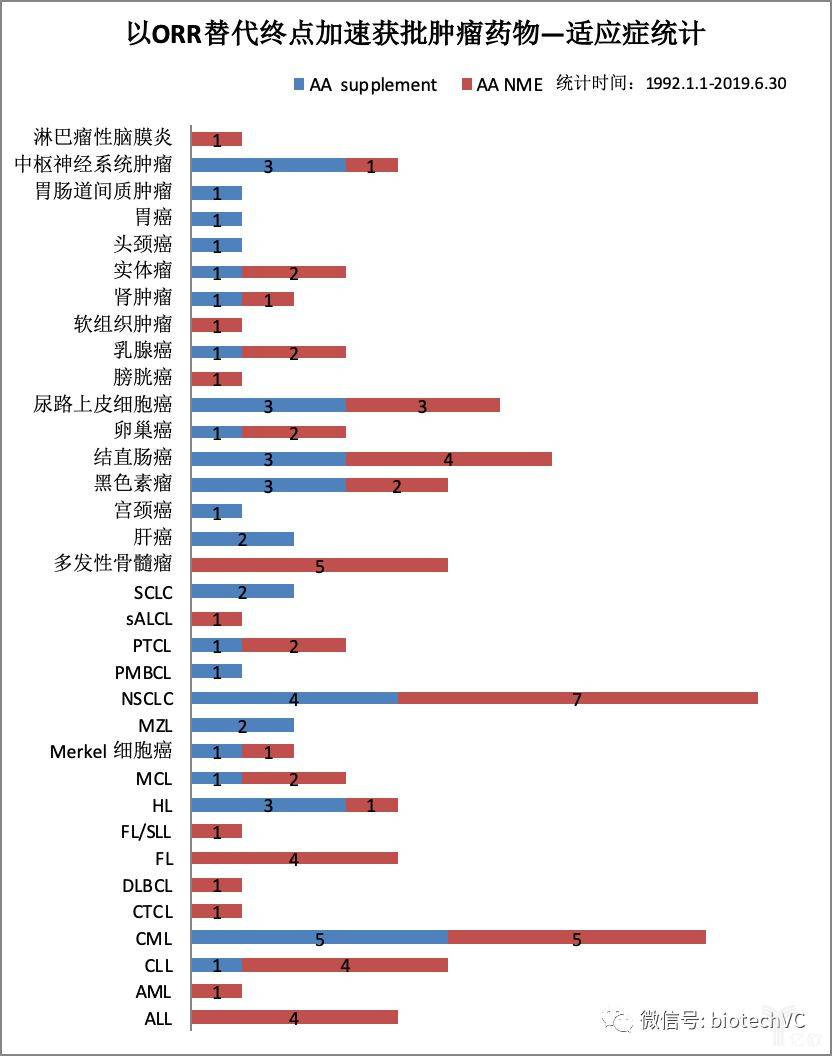
图6 肿瘤药物验证分类统计
三、FDA历年来以ORR作为替代终点加速审批的肿瘤药物
从上述数据得知在加速审批中,排名居前两位的替代终点是ORR和PFS,其中PFS在之前文章专篇分享过,所以本文将重点分析下另一替代终点ORR。
理想的肿瘤治疗应该是让患者活的更长、更好,肿瘤临床试验终点应显示患者生存或生活质量有临床意义的改善。而如今ORR已成为支持加速审批的最常使用的替代终点,是由于ORR可以直接归因于药效,对于在当前没有治疗方法的难治性肿瘤患者中所进行的单臂研究可以准确评价ORR。所以,ORR替代终点的引入被肿瘤学家逐渐接受,在肿瘤药物治疗中发挥着重要作用。
第一,我们来看下有哪些细分适应症是通过ORR替代终点加速获批的呢?排名前三位的适应症分别是非小细胞肺癌NSCLC共有11个,CML共有10个,结直肠癌共有7个。除此之外,还有多种其它实体瘤和血液瘤也是通过ORR获批上市(见图7)。
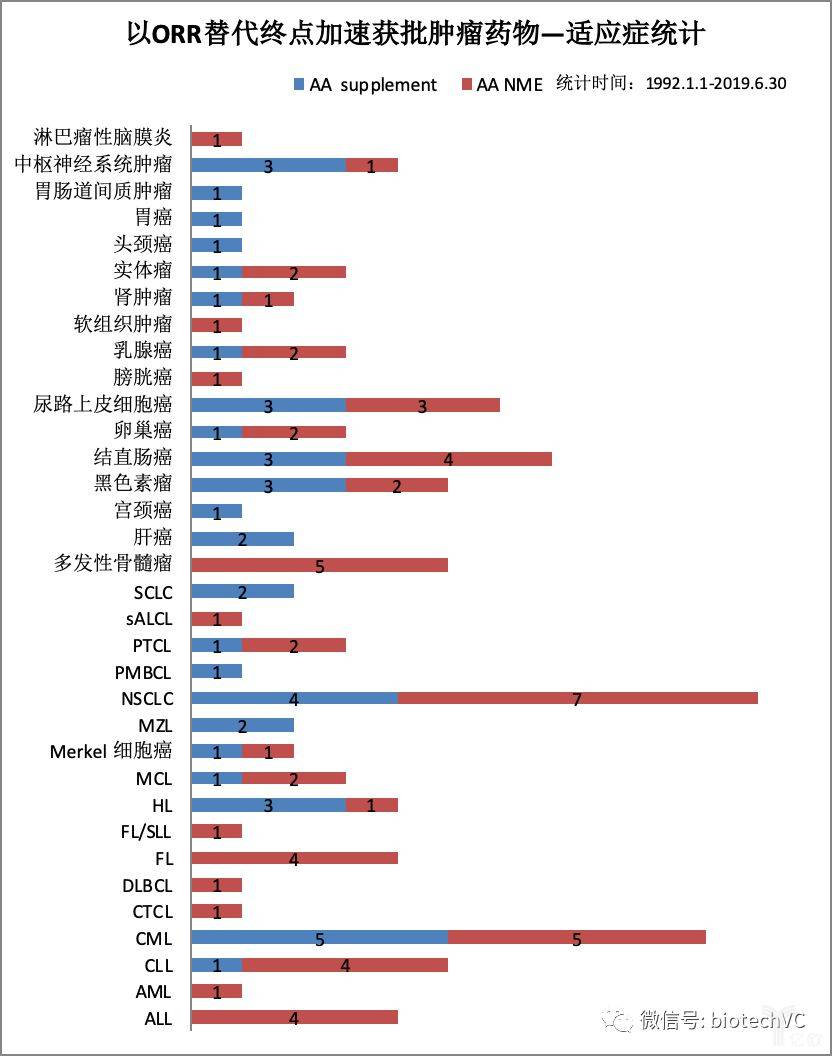
图7 肿瘤ORR替代终点适应症分类统计
第二,在以ORR替代终点加速审批的103个药物在上市后临床验证试验是采用什么终点呢?截至目前上述药物已经有56(54.36%)个完成上市后临床验证且证明临床获益,只有4(3.88%)个药物在验证性试验尚无获益或者申请人未完成并主动撤销,还有43(41.75%)个正处于临床试验进行中。
在已验证临床获益的56个药物中,采用的三期验证终点见图8,其中有13(23.31%)个药物同样采用ORR作为验证终点;有22(39.29%)更换为另一替代终点PFS;更有20(37.71%)个是以临床生存获益OS作为直接的验证终点。
在上述经过验证且获益的56个药物中,从加速批准到三期验证的平均时间为4.1年(范围为0.4-13.7年),其中大部分是在批准时正在进行验证性试验。而到统计时间段尚未经过验证性的43个药物中,有35(81.4%)个加速批准时间处于2015年-2019年,均不足于既往平均时间。
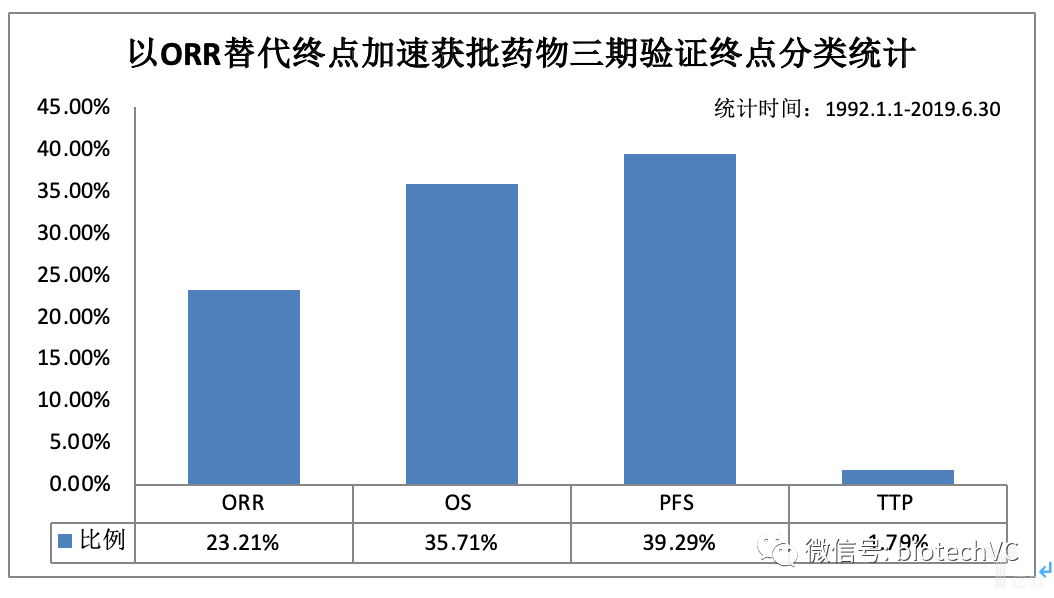
图8 三期验证性试验终点分类统计
四、总结
经过FDA历年来加速批准的药物数据统计分析得知,ORR替代终点是加速审批中最为常用的指标,且经过ORR加速上市的药物中只有3.88%药物在验证性试验尚无获益或者申请人未完成并主动撤销。所以,这也表明基于ORR替代终点的加速审批可以成功的用于加快批准安全有效的癌症治疗方法。
ORR替代终点的引入为新药审批过程节省了很多时间,如FDA可基于肿瘤得到缩小的证据(而不再基于患者服用该药后是否能活得更久)而批准该抗癌新药。而若肿瘤临床试验中以患者生存获益OS和健康相关生活质量属于终点结局指标,探究该指标的差异相对来说需要更长的研究时间,所以基于能够合理预测临床获益的替代指标加速批准药物上市,可以让患者能够比常规批准途径更早获得能够延长寿命的肿瘤药物治疗。
随后通过上市后进行大规模的临床疗效验证试验就显得尤为重要。如果上市后确认试验证明临床获益的情况下,FDA则维持原先的批准;若确证试验证明临床获益失败或没有表现出足够的临床获益来证明与药物相关的风险(例如,比预期的基于观察得到的替代效果相比,显示出更小的幅度或持续时间),那么之前获批的药物有可能会被撤回,或者说之前批准的适应症有可能会被要求更改。所以及时完成上市后试验对提供数据以验证所有临床效益至关重要。
来源:Biotech 作者:VC李芳
四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..