11月28日,中国国家医保谈判准入药品名单公布,信达生物旗下的创新抗肿瘤新药信迪利单抗注射液(达伯舒)成功入围,成为中国医药史上首个也是目前唯一一个进入国家医保目录的PD-1肿瘤免疫疗法。这在中国创新药和肿瘤免疫疗法发展过程中具有标志性意义的一件事。
信迪利单抗于2018年底在中国获批,后又被列入2019版《CSCO淋巴瘤诊疗指南》,推荐用于治疗复发/难治性经典型霍奇金淋巴瘤(R/R-cHL)。业界认为,它的诞生标志着中国霍奇金淋巴瘤治疗正式迈入免疫疗法时代。这篇文章我们再共同回顾下信迪利单抗不平凡的研发历史。
神秘的PD-1
2018年10月1日,日本京都大学(Kyoto University)医学部,一栋其貌不扬的教学楼内一派忙碌的景象,不同肤色的研究人员身着白大褂,穿梭于办公室与实验室之间,不过,如果你仔细打量一番便会发现,今天的气氛似乎有点不同寻常,这里的每一个人,脸上都洋溢着兴奋与自豪——原来,瑞典卡罗琳斯卡医学院(Karolinska Institute)刚刚宣布将本年度诺贝尔生理学或医学奖授予京都大学本庶佑(Tasuku Honjo)教授,而引领他登上斯德哥尔摩诺贝尔奖领奖台的,则是一种神秘的分子——PD-1。

▲本庶佑教授团队找到了PD-1(图片来源:By 大臣官房人事課(平成25年度 文化勲章受章者:文部科学省) [CC BY 4.0 (https://creativecommons.org/licenses/by/4.0)], via Wikimedia Commons)
PD-1全名是程序性死亡蛋白1(Programmed Cell Death Protein 1),1992年,本庶佑教授团队首次在T细胞上发现了这种分子,其后发现它有抑制免疫系统的作用。1999年,陈列平教授团队在Nature Medicine上发表文章,报道了B7家族的第三个成员B7-H1,这便是后来名声大噪的PD-L1。其后一系列研究证实:PD-L1能够与PD-1结合,从而抑制T细胞的增殖和细胞因子的分泌,负调控T细胞的激活。
随着PD-1/PD-L1通路对T细胞的负调控作用被发现,研究人员逐渐意识到,这条通路或许可用于自身免疫疾病药物的开发,以美国Medarex公司、荷兰Organon公司为代表的一些医药企业也纷纷开始利用这一原理开发肿瘤药物。尽管开发PD-1抑制剂之路绝非坦途,但经过科研人员的不断努力,以及在临床试验中取得越来越多的积极数据,2012年,PD-1已一跃成为肿瘤治疗领域最热的靶点之一。2013年,癌症免疫疗法被 Science评为年度十大科技突破之首。
研发代号IBI308
正当PD-1抑制剂在全球医药圈引发普遍关注、各大药企纷纷跟进之时,在大洋彼岸的中国,俞德超博士也将目光投向了这个新兴领域。
在生物制药领域,俞德超博士的经历颇具几分传奇色彩。1964年,俞德超出生在浙江省天台县的一个偏僻山村,1982年,他考入浙江林学院经济林专业,此后连跨专业,从南京林业大学植物生理学硕士,再到中科院分子遗传学博士,最后在美国加州大学旧金山分校(UCSF)从事药物化学专业博士后研究。由信达生物官网公开信息可知,俞德超博士团队曾发明出全球首个肿瘤溶瘤免疫治疗类抗肿瘤药物“安柯瑞”(重组人5型腺病毒注射液);他还共同发明并领导开发了中国首个拥有自主知识产权的单克隆抗体新药“朗沐”(康柏西普眼用注射液)。2011年,俞德超博士创立了信达生物。
“2012年,国外免疫节点蛋白抑制剂相关研究已经取得了很好的数据,展现出了极大的潜力。”为了满足无数患者的未竟医疗需求,俞德超决定抓住这个时机,在中国开发免疫节点蛋白PD-1的单克隆抗体。2012年,信迪利单抗正式立项,研发代号IBI308。
27个月的“奇迹”
巧选适应症
新药研发被普遍认为是一项高风险、高收益的活动,业界一直流传着“双十”的说法,即新药研发需要耗时10年、耗资10亿美元。尤其是新药的临床试验阶段,往往需要花费五六年的时间,且失败率高达90%以上。对于PD-1抑制剂而言,目前国际上的主流药物包括百时美施贵宝(BMS,收购了Medarex公司)的Opdivo(俗称O药),以及默沙东(MSD,收购了Organon公司)公司的Keytruda(俗称K药)等,其研发过程均是一波三折,历时弥久。
那么,信迪利单抗交出了怎样的一张答卷?答案是:27个月!2016年9月,信迪利单抗(一种全人源化IgG4单克隆抗体)获得中国国家药品监督管理局(NMPA)的批准,开始进入临床试验。2018年12月24日,信迪利单抗获得NMPA批准正式上市。从拿到临床试验批文到正式上市,信迪利单抗进度之快令人惊叹。那么,在“奇迹”的背后,又隐藏着怎样的秘密?
“从临床到上市,信迪利单抗步伐很快,关键原因之一便是在新药开发策略上,首先选择了一个恰当的适应症——复发/难治性经典型霍奇金淋巴瘤。”俞德超博士表示。众所周知,复发/难治性经典型霍奇金淋巴瘤国际上通用的标准治疗是自体造血干细胞移植(ASCT),不过,由于各种因素的限制,很多患者无法接受这类治疗。“百时美施贵宝的O药和默沙东的K药均将目光瞄准了这一瓶颈,并且取得了很好的临床数据,这也让信达生物深受鼓舞,坚定了首先开发这一适应症的信心。”俞德超博士如是说。
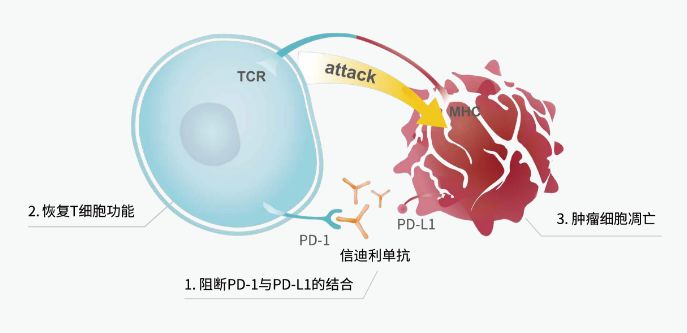
▲信迪利单抗作用机理(图片来源:信达生物官网)
荣登《柳叶刀•血液学》封面
临床试验是新药开发中的关键一环,无数原本被寄予厚望的新药候选者都倒在了这个阶段。医院与医生资源紧缺、患者招募竞争激烈、相关机构审评审批机制尚待完善……信迪利单抗面对的,是一条布满了荆棘的道路。然而,借中国大力扶持创新药研发之东风,信达人充分发扬了“啃硬骨头”的精神,努力跨越每一道难关,使得信迪利单抗不但经受住了炼狱式的考验,还交出了一份优异的成绩单。
2019年1月,信迪利单抗成为首个登上权威医学期刊《柳叶刀•血液学》(The Lancet Haematology)封面的中国国产PD-1抑制剂。信达生物临床科学与战略部副总裁周辉博士表示:“信迪利单抗赢得国际权威学术杂志的认可,主要有三方面的原因:其一,在临床研究中,信迪利单抗取得了非常好的安全性和有效性的数据;其二,与国际一流药企礼来(Eli Lilly and Company)达成战略合作,确保了围绕信迪利单抗开展的每一项工作都符合国际标准;其三,在复发/难治性经典型霍奇金淋巴瘤的治疗中,取得了现有标准治疗没有办法达到的抗肿瘤结果效应。”来看看信迪利单抗关键临床试验ORIENT-1(2期多中心单臂研究)的数据:客观缓解率(ORR)为85.4%,完全缓解率(CR)为42.7%,疾病控制率(DCR)为97.8%,且总体安全性良好。

▲2019年第1期《柳叶刀•血液学》封面,其中的恶龙象征复发/难治性经典型霍奇金淋巴瘤(图片来源:The Lancet Haematology)
“一个好汉三个帮”
商场上有这么一句格言:一款成功的产品的背后,一定站着一个优秀的团队。携手礼来,使信达生物获得了稳定的资金,降低了研发风险,并促使其打造出一个符合国际标准的高端生物药产业化基地;具有国际先进水平的高端生物药研发团队,为信达生物不断迈步向前、取得一个又一个新突破奠定了最坚实的基础。作为临床研究合作伙伴,药明康德子公司康德弘翼(WuXi Clinical)为信迪利单抗多项3期临床试验提供了全方位、定制化服务,在进度和质量方面取得阶段性的成果,为信迪利单抗产品研发计划的顺利推进赢得了宝贵的时间。
“信迪利单抗的诞生,离不开众多合作伙伴的保驾护航。”俞德超博士不无感慨地说道。
新的征程
PD-1抑制剂作为非特异性免疫治疗产品,有着“广谱抗癌神药”之美誉。以O药和K药为例,在全球范围内,两者均有多个癌种、十多项适应症获得批准。已获批治疗复发/难治性经典型霍奇金淋巴瘤的信迪利单抗,其后又会瞄准哪些新适应症?
2019年9月,第20届世界肺癌大会(WCLC)在西班牙巴塞罗那盛大召开,上海市胸科医院韩宝惠教授在会上汇报了信迪利单抗联合安罗替尼一线治疗驱动基因(EGFR/ALK/ROS1)阴性晚期非小细胞肺癌(NSCLC)的1期临床研究结果,主要研究终点客观缓解率(ORR)为72.7%,疾病控制率(DCR)则高达100%,有望成为晚期NSCLC一线治疗新的选择。
“目前信达生物同时在中、美推进了有关信迪利单抗的20多项临床试验,其中包括8项注册临床研究,涵盖肝癌、肺癌、胃癌、食管癌等多个癌种,尤其是在中国,这些疾病都有着很大的患者群体,”俞德超博士说:“在早期研究中,已经观察到了很好的疗效,相信随着研究的进一步深入,信迪利单抗在其他适应症方面也大有可为。”
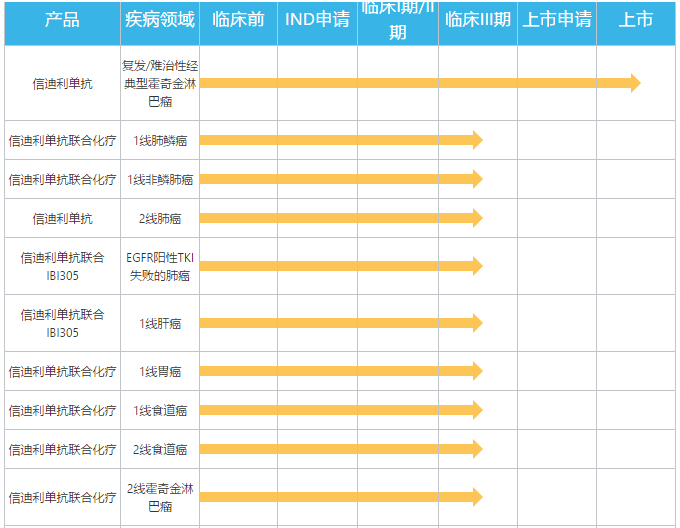
▲信迪利单抗研发管线(图片来源:信达生物官网)
“做药人”的价值
2018年被很多人誉为中国免疫治疗的元年。这一年,让患者们翘首以盼多年的进口PD-1抑制剂终于在中国上市,然而,这还远远无法满足中国众多患者的需求。“开发出老百姓用得起的高质量生物药”,既是促使俞德超博士放弃国外优异条件、回国创业的初衷,也是信达生物创立后一直追寻的使命与梦想。
图片来源:信达生物官网
2019年3月9日,信迪利单抗正式开售,信达生物以较低的价格向着实现生物药“高端”但不“高价”迈出了坚实的一步。“心系患者一片情”,俞德超博士表示,为了进一步减轻贫困患者的负担,信达生物已与中国癌症基金会合作,发起了“达伯舒卫生扶贫公益项目”,该项目将为全国低保和建档立卡的复发/难治性经典型霍奇金淋巴瘤患者免费提供2年的信迪利单抗药品援助,帮助患者治疗疾病、减轻经济负担,助力国家卫生健康扶贫工作。
对于俞德超博士而言,看到越来越多的患者因信迪利单抗受益,是他最大的欣慰。一名罹患复发/难治性经典型霍奇金淋巴瘤的大学生,曾接受过各种放疗、化疗及干细胞移植治疗,但均效果不佳,被医生判定只剩下几个月的生命,绝望之中,他接受了信迪利单抗的治疗,成功痊愈,获得了新生。类似的患者案例还有许许多多,俞德超博士充满深情地说道:“患者获益给了信达生物研究团队极大的鼓舞,这既是做药人的价值,也是信迪利单抗的使命所在。”
2019年8月29日,信达生物公布了2019年度中期业绩,信迪利单抗的表现尤为亮眼。对此,俞德超博士给出了这样的评价:“信迪利单抗的优异表现说明,其疗效和安全性已得到众多患者和肿瘤医生的认可。同时,国家对提高创新药可及性一系列的利好政策,也是取得这一成绩的重要保证。”
信迪利单抗的成功,给中国的创新药研发带来了怎样的启示?俞德超博士认为,从它的研发历程可以看出,中国的新药研发正处在一个非常好的时代,有了这样的大环境,会激励越来越多的科学家乃至资本市场投入创新药的开发工作。他希望,中国的企业能够真正静下心来,专心致志做好产品,同时,“每一个做药的人都应该心怀感激之心,因为正是这项工作,给了他们帮助无数人的机会。”
我们祝贺这款肿瘤免疫疗法谈判成功,进入中国国家医保目录,更好地造福患者。我们也期待信达生物能够在未来再获突破,为造福全球患者做出更大的贡献。
欢迎扫码关注“医药观澜”微信公众号,了解更多中国医药创新动态。
参考资料:
[1] Haidong Dong, Gefeng Zhu, Koji Tamada & Lieping Chen.(1999)B7-H1, a third member of the B7 family, co-stimulates T-cell proliferation and interleukin-10 secretion. Nature Medicine, doi:10.1038/70932
[2]Yuankai Shi, Hang Su, Yongping Song, et al. (2019)Safety and activity of sintilimab in patients with relapsed or refractory classical Hodgkin lymphoma (ORIENT-1): a multicentre, single-arm, phase 2 trial. The Lancet Haematology,doi:10.1016/S2352-3026(18)30192-3
[3]Han BH,Chu TQ,Zhong RB,et al.Efficacy and safety of sintilimab with anlotinib as first-line therapy for advanced non-small cell lung cancer (NSCLC)[EB/OL].WCLC 2019,abstract P1.04-02.
协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..