本文调研了近期在国际学术期刊上报道的具有一定治疗潜力的新兴药物靶标的研究进展,汇总了靶标的适应症及相关候选药物的研发进展,主要涉及肿瘤、非酒精性脂肪性肝炎、肥胖、感染性疾病、老年性痴呆等多个疾病领域,以期为相关科研人员提供学术参考。
概述
新兴靶标的发现仍然是药物研发的关键,科学家针对不同疾病领域进行潜在药物靶标的研发工作日渐更新。本文调研和统计了近期发表于国际学术期刊上的重要潜在药物靶标的研究情况,并作简要介绍。同时,通过查询Clarivate Analytics Integrity数据库(检索日期:2019年7月19日),对不同靶标候选药物的研发进展进行阐述(表1)。
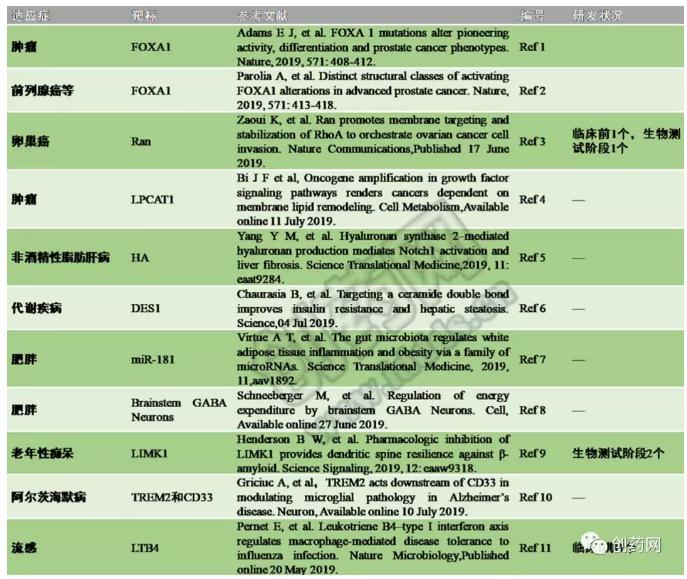
表1:近期报道的新型药物靶标列举
肿瘤
FOXA1
转录因子FOXA1中一个独特部分的突变导致了前列腺癌,但是人们并不知道这些突变的功能性后果以及它们是否导致功能的获得或丧失。在一项新的研究中,研究人员通过对来自3086种人类前列腺癌的FOXA1突变景观进行注释,在FOXA1的叉头结构域(Forkhead domain)中确定了两个热点:Wing2(约占所有突变的50%)和高度保守的DNA接触氨基酸残基R219(约占所有突变的5%)。Wing2突变在腺癌的各个阶段都能检测到,而R219突变在具有神经内分泌组织学特征的转移性肿瘤中富集。相关研究结果于2019年6月26日在线发表在Nature期刊上,论文标题为“FOXA1 mutations alter pioneering activity, differentiationand prostate cancer phenotypes”(Ref 1)。对野生型FOXA1和14种FOXA1突变体的生物学特性开展的研究揭示出这些突变体在小鼠前列腺类器官增殖试验中发生了功能获得。这些突变体中的12种以及野生型FOXA1促进了一种增强的促管腔分化程序,而两种不同的R219突变体阻断了管腔分化并激活了一种间充质和神经内分泌转录程序。在另一项新的研究中,来自美国密歇根大学罗杰尔癌症中心的研究人员发现基因FOXA1以三种不同的方式颠覆了正常的生物学规则来驱动前列腺癌产生。他们将这三种类型称为FAST、FURIOUS和LOUD,以反映它们的独特特征。相关研究结果于2019年6月26日在线发表在Nature期刊上,论文标题为“Distinct structural classes of activating FOXA1alterations in advanced prostate cancer”(Ref 2)。
在此之前,人们已知FOXA1在前列腺癌中发生突变,但是对它的生物学功能却知之甚少。科学家们不确定FOXA1是一种促进癌症产生的癌基因,还是一种抑制癌症的肿瘤抑制基因。如今,这些研究人员阐明了FOXA1作为驱动癌基因的作用,此外,还对FOXA1的三种新的突变进行了分类。研究人员还发现这三种类型的FOXA1变化也存在于乳腺癌中,并且很可能以类似于它影响雄激素受体的方式影响雌激素受体。FOXA1基因变化也与膀胱癌和一些唾液腺癌有关。
Ran
癌症复发转移十分凶险,一旦出现,肿瘤的生长速度是非常快的。而已知90%以上的癌症患者其实是死于复发转移。近日,来自加拿大蒙特利尔大学医院研究中心(CRCHUM)的研究人员揪出了卵巢癌转移的“帮凶”--它是一种名为Ran的蛋白质。研究人员证明,如果没有Ran的帮助,卵巢癌细胞不能从癌变部位迁移。相关研究结果以“Ran promotes membrane targeting and stabilization of RhoA to orchestrateovarian cancer cell invasion”为题发表在Nature Communications杂志上(Ref 3)。Ran是一种核质穿梭蛋白,与癌症发展和生存有关,主要支持细胞内部和细胞核之间的转运。由蒙特利尔大学医院研究中心Anne-Marie Mes-Masson博士和Diane Provencher博士领导的研究小组发现,在卵巢癌细胞中,Ran是细胞膜的另一种蛋白RhoA的“出租车”,而RhoA在细胞迁移中起重要作用。目前,研究人员已经着手开发能抑制Ran的小分子,并在他们开发的临床前模型中进行测试,以证明它们可以减缓或消除癌症的发展。他们希望,这些新药将来能进入临床造福于卵巢癌患者。目前,以Ran靶标开发的候选药物临床前1个,生物测试阶段1个。
LPCAT1
近日,加州大学圣地亚哥分校Ludwig癌症研究所的Paul Mischel教授领导的研究团队通过DNA测序技术发现了一种可覆盖数十种癌症的新靶点,可谓是一招制敌,推动了癌症靶向治疗的发展,也为新药的研发提供了理论基础,相关文章以“Oncogene Amplification in Growth Factor SignalingPathways Renders Cancers Dependent on Membrane Lipid Remodeling”为题在线发表在Cell Metabolism杂志上(Ref 4)。该研究小组已确定了一种名为LPCAT1(溶血磷脂酰胆碱酰基转移酶)的酶,其能改造多种类型癌细胞的质膜(质膜对于肿瘤的生存与不受控制的生长有着至关重要的作用),促进肿瘤的形成与进展。靶向该酶后,能急剧缩小多种肿瘤,延长小鼠生存期。LPCAT1通过改变癌细胞质膜的磷脂组成,从而使致癌受体可以适当定位于细胞表面,进而扩增和改变生长因子信号以刺激肿瘤生长。在该研究中,其确定癌症中的生长因子信号系统中的一些常见基因组改变与质膜改变之间的关键酶促联系,得以发现可破坏引起癌细胞增殖的生长因子信号转导途径,进而可阻断肿瘤的不可控的增殖,也为新药研发提供新的方向。这些结果也表明LPCAT1可能是各种癌症类型中非常引人注目的新药靶点。
非酒精性脂肪性肝病
HA
日前,一篇发表在国际杂志Science Translational Medicine上的题为“Hyaluronan synthase 2-mediated hyaluronanproduction mediates Notch1 activation and liver fibrosis”的研究中(Ref 5),来自昆士兰大学的科学家们通过研究鉴别出了治疗慢性肝脏疾病的可能性药物靶点,文章中,研究人员发现了与慢性肝脏疾病进展相关的特殊基因。研究者表示,透明质酸(HA,Hyaluronan)分子能作为肝脏疾病的标志物,其在疾病进展过程中扮演着关键角色;检测血液中透明质酸的水平就能揭示患者肝脏疾病的严重程度,但截至目前为止,研究人员并不清楚透明质酸在慢性肝脏疾病进展中扮演的具体角色和作用。这项研究中,研究者利用来自患者的临床样本进行研究证实,在晚期肝脏疾病患者的血液中制造透明质酸的酶类的水平往往较高;这就意味着,透明质酸并不仅仅是一种标志物,而且是一种潜在的药物靶点。
DES1
胰岛素抵抗和脂肪肝是糖尿病和心脏病的主要危险因素。在一项新的研究中,来自美国、巴西、澳大利亚和文莱的研究人员发现一种小的化学变化--改变两个氢原子的位置,使得健康的小鼠和具有胰岛素抵抗性和脂肪肝的小鼠之间存在差异。进行这种改变可阻止摄入高脂肪饮食的小鼠出现这些症状,且逆转肥胖小鼠中的前驱糖尿病(Prediabetes)。相关研究结果于2019年7月4日在线发表在Science期刊上,论文标题为“Targeting a ceramide double bond improves insulinresistance and hepatic steatosis”(Ref 6)。研究人员通过让一种称为二氢神经酰胺去饱和酶1(Dihydroceramidedesaturase 1,DES1)的酶失活来改变代谢疾病的轨迹。这样做可阻止这种酶从称为神经酰胺的脂肪脂质中移除两个氢原子,因而,具有降低体内神经酰胺总量的作用。DES1的作用是通常将一个保守的双键插入到神经酰胺和其它主要鞘脂类的主链中。这一发现突出了神经酰胺在代谢健康中的作用,并指出DES1是一种“可被药物靶向的”靶标,可能能用于开发治疗前驱糖尿病、糖尿病和心脏病等代谢紊乱的新方法。
肥胖
miR-181
肠道菌群对白色脂肪组织(Whiteadipose tissue,WAT)的调节是一种在维持代谢健康中起关键作用的过程,而且肠道失调可导致肥胖和胰岛素抵抗性(Insulin resistance,IR)的产生。然而,肠道菌群如何调节白色脂肪组织功能仍然在很大程度上是未知的。一项新的研究发现,高脂肪饮食导致小鼠白色脂肪组织中的miR-181激活,随后导致肥胖、胰岛素抵抗性和白色脂肪组织炎症。相关研究结果发表在2019年6月12日的Science Translational Medicine期刊上,论文标题为“The gut microbiota regulates white adipose tissue inflammation andobesity via a family of microRNAs”(Ref 7)。在白色脂肪组织中,他们把关注点放在了一类被称为微小RNA(miRNA)的分子上。miRNA是小片段的非编码RNA,广泛表达在动植物中,调节基因表达,有人称之为基因表达的“微调器”。研究人员发现,在高脂饮食的胖小鼠体内,被称为miR-181家族的miRNA在白色脂肪组织中特异性地增多。研究结果提示,当饮食引起肠道菌群失调时,或许可从细菌代谢产物到调节基因表达的微小RNA家族miR-181入手,来直接调节脂肪组织和能量代谢,帮助治疗肥胖。
Brainstem GABA Neurons
近日,美国洛克菲勒大学与普林斯顿大学的研究人员合作,在生命科学顶级期刊Cell上发表了一项重要研究“Regulation of energy expenditure by brainstem GABA Neurons”(Ref 8)。他们发现了一组可同时调控食物摄入量和能量消耗的脑干神经元,基于这一靶点,人们有望开发更为有效的减肥药物。研究结果表明,抑制脑干DRN的GABA能神经元可减少食物摄入量,同时,增加能量消耗,达到双重抑制肥胖的积极效果。目前,科学家们正在寻找控制该这些GABA能神经元的受体,以期基于这一靶点研发新型的减肥药物,在抑制肥胖的治疗中发挥更显着的功效。
老年性痴呆
LIMK1
阿拉巴马大学伯明翰分校(UAB)的科学家们发现了大脑中的一种酶,这种酶可能是治疗阿尔茨海默病和其它痴呆症的潜在靶点。研究人员认为,这种被称为LIMK1的丝氨酸/苏氨酸激酶,可能在树突棘的降解中起到重要作用。树突棘是连接大脑神经元的物质。6月25日发表在Science Signaling杂志上的一篇论文中“Pharmacologic inhibition of LIMK1 provides dendritic spine resilienceagainst β-amyloid”(Ref 9),研究小组报告了一种实验药物的使用,这种药物似乎成功地抑制了LIMK1,并为树突棘提供了一定程度的保护。树突棘就像是连接一个神经元和另一个神经元的桥梁。Herskowitz实验室之前的研究表明,树突棘更长、数量更多的人不会出现痴呆症状,即使他们有众所周知的淀粉样斑块累积和tau蛋白缠结的阿尔茨海默病病理学。在健康的大脑中,LIMK1似乎可调节树突棘的大小和密度。痴呆症患者的大脑中这种酶活性过高,导致树突棘受损。在这项研究中,开发了一种实验性药物,通过抑制LIMK1活性对树突棘提供保护作用。LIMK1受另外两种已知与痴呆症有关酶的调节。这两种Rho相关激酶被称为ROCK1和ROCK2,在早期阿尔茨海默病患者脑中增加。世界范围内的许多研究人员都将ROCK1和ROCK2作为老年痴呆症的潜在干预目标。事实证明,ROCK激酶是一种具有挑战性的药物靶点,因为抑制它们可能会导致严重的副作用,包括血压下降到足以导致死亡的程度。然而,LIMK1处于信号通路下游,受ROCK,尤其是ROCK2的调节。据目前所知,LIMK1的抑制对ROCK没有影响,因此,可能不会产生同样严重的副作用。目前,靶向LIMK1有2个生物测试阶段候选药物。
TREM2和CD33
近日,一项刊登在国际杂志Neuron上的题为“TREM2 acts downstream of CD33 in modulating microglial pathology inAlzheimer’s disease”研究中(Ref 10),来自麻省总医院的研究人员通过研究阐明了如何有效抑制大脑组织的炎症表现,大脑组织的炎症会促进阿尔茨海默病的发生,相关研究结果有望帮助研究人员开发治疗阿尔茨海默病的新型疗法。2008年,研究人员发现了与阿尔茨海默病患者大脑神经炎症相关的第一个基因--CD33,其能携带编码小胶质细胞表面受体的遗传代码,小胶质细胞能作为大脑的“管家”,有效清除大脑中的神经碎片,包括淀粉样斑块和tau蛋白缠结等;2013年,研究发现,CD33能影响小胶质细胞的活性,当该基因高度表达时,小胶质细胞就会从大脑“管家”的角色转变为神经元杀手,从而诱发神经炎症发生。此外,研究还调查了另外一种名为TREM2的基因,该基因与CD33具有相反的效应,其能关闭小胶质细胞促进神经炎症的能力。研究者表示,TREM2在CD33的下游发挥着控制神经炎症的作用,而这一理论得到了小胶质细胞RNA测序结果的支持,这就提示CD33和TREM2能通过增加或降低免疫细胞IL-1β及细胞受体IL-1RN的活性来调节神经炎症的发生。最后,研究者Tanzi说道,如今越来越意识到需要开发出阿尔茨海默病新型疗法,而最关键的是阻断因神经炎症所引发的大量大脑神经细胞的死亡,CD33和TREM2基因或许有望成为未来开发新型药物的潜在靶点。
流感
LTB4
近日,一项刊登在国际杂志Nature Microbiology上的题为“Leukotriene B4-type I interferon axis regulatesmacrophage-mediated disease tolerance to influenza infection”研究中(Ref 11),来自麦吉尔大学健康中心的科学家们通过研究解决了这个基本问题,研究者鉴别出了一个新型靶点,其能帮助降低机体应对流感病毒感染的过度活跃的免疫力,文章中,研究人员阐明了脂质介导子白三烯B4(LeukotrieneB4,LTB4)在肺部中扮演的关键角色。研究者发现,LTB4分子不仅能降低机体免疫反应所引发的组织损伤,还能增强宿主的生存率,相关研究发现有望帮助研究人员开发治疗流感的新型疗法。研究者表示,对于未来临床研究非常重要的是,在疾病高峰时单剂量的LTB4就足以明显降低肺部的免疫病理学表现和组织损伤,并改善宿主的生存率。目前有多种靶向作用脂质通路的药物(比如阿司匹林)能帮助控制人类的感染症状及其它免疫性疾病,比如哮喘等,因此,靶向作用特殊宿主脂质的新型免疫疗法策略或许在治疗流感或其它病毒感染上有着巨大的临床意义。目前,靶向LTB4受体药物有1个处于临床Ⅱ期。
来源:创药网 作者:杨益平
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..