▎医药观澜/报道
每年8月,是国际SMA关爱月。SMA是一种严重的遗传性神经肌肉疾病——脊髓性肌萎缩症(Spinal Muscular Atrophy)的简称。这种遗传病对婴幼儿威胁很大,由于大多数1型SMA患者无法活过两周岁,SMA也被称作婴幼儿的头号遗传病杀手。
SMA的发病根源在于,一种被称为运动神经元生存蛋白(survival motor neuron, SMN)的缺失或失常导致。SMN蛋白对于维持人体运动神经元存活至关重要,人体内有两条可以生成SMN蛋白的基因,分别是SMN1基因和SMN2基因,但SMN1基因占主导作用,SMN2基因仅产生少量SMN蛋白(约10%)。因此,一旦SMN1基因功能失常,就会导致患者无法生成足够的运动神经元生存蛋白,患者运动神经元迅速死亡,肌肉功能逐步丧失,最终导致瘫痪,且无法完成吞咽、呼吸等维持生命的基本活动,严重威胁患者生命。

▲图片来源:123RF
公开数据显示,SMA这种病致病基因的携带率非常高,全球每45~50人中就有1人携带SMA致病基因。虽然SMA主要是在婴幼儿期发病,但患者可能是从婴儿至成人的任何年龄段,临床上通常分为SMA1型、SMA2型、SMA3型,即婴儿型、中间型及成年型,其中婴幼儿期的1型SMA最有常见。
尽管这种疾病威胁很大,但幸运的是,由于其致病因较为明确,SMA成为最有望取得研究突破的神经肌肉疾病之一。过去几十年,随着人类对这种疾病遗传学和病理生理学理解的不断加深,为药物治疗和基因治疗提供了基础。
尤其近几年,可以说是开创了药物治疗的新纪元。2016年全球首款SMA药物Spinraza获批在美国上市,之后陆续在多个国家上市,给越来越多的SMA患者带来了新生。进入2019年,SMA的治疗格局发生新的变化,美国FDA于5月批准了第一款SMA基因替代疗法。而在中国,SMA患者也正迎来新的治疗希望。
渤健:全球首款SMA药物Spinraza注射液
2016年,全球首款SMA药物Spinraza(诺西那生钠注射液)获得FDA批准在美国上市,并被授予孤儿药资格。这是渤健(Biogen)旗下的一款反义寡核苷酸(antisense oligonucleotide, ASO)药物,最早与Ionis公司合作开发,渤健于2016年获得该药全球独家权利。
Spinraza的作用机理是,通过与SMN2基因转录形成的mRNA相结合,改变RNA的剪接过程,从而增加正常SMN蛋白的表达量。这一疗法可以在SMN1基因失活的SMA患者身上增加正常SMN蛋白的水平,从而维持运动神经元的生存。2018年,Spinraza荣获“医药界的诺贝尔奖”——国际盖伦奖2018年度最佳生物技术产品大奖。
该药首次获批后,陆续在全球多个国家和地区获批上市,为更多SMA患者带来了治疗希望。目前Spinraza已在40多个国家和地区获批。截至2018年6月30日,全球已有超过8400名婴儿、儿童或成人SMA患者接受了该药的治疗。2019年2月,Spinraza正式在中国获批,用于治疗5q SMA。5q SMA是该病的最常见形式,约占所用SMA病例的95%。这给中国患者带来了首款SMA治疗药物。
诺华:全球首款SMA基因替代疗法
2019年5月3日,美国FDA批准了第一款SMA基因替代疗法 。这款疗法是由诺华(Novartis)公司开发的Zolgensma,用于治疗1型SMA患者。
Zolgensma是一款基因疗法,它将能够正常表达SMN蛋白的转基因装载在AAV9病毒载体中,并且对转基因进行了改良,能够提高生成SMN蛋白的能力。该药的设计旨在让患者接受1次治疗后,能够在细胞中长期表达SMN蛋白,从而达到“治愈性”效果。
据悉,已经有超过150名患者接受了Zolgensma的治疗,研究表明95%的患者不会因为体内对AAV9的抗体水平而无法接受这一基因疗法的治疗。基于其优势,该基因疗法曾获FDA授予突破性疗法认定,欧盟的PRIME(重点药品快速审评程序)认定和日本的SAKIGAKE(先驱药品)认定。该药最初由AveXis公司开发。2018年,诺华收购AveXis并获得这款基因疗法。
罗氏:口服SMN2 RNA剪接调节剂risdiplam
除了已经获批上市的两款疗法,全球领域还有多款针对SMA的在研项目处于临床阶段。医药观澜查询Clinicaltrials.gov,上面登记了全球共计19项针对SMA的临床研究,分别来自AveXis、渤健、罗氏、GSK和诺华等多家公司。
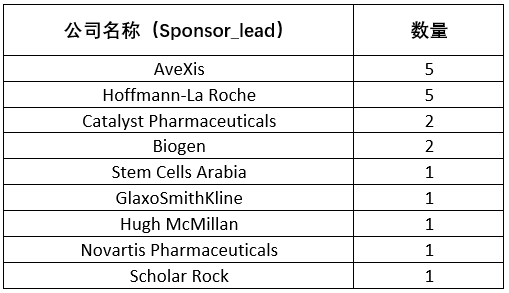
▲全球SMA临床研究项目登记信息(数据来源:Clinicaltrials.gov)
其中备受关注的是,由罗氏(Roche)与SMA基金会和PTC Therapeutics合作开发的一款口服SMN2 RNA剪接调节剂risdiplam,该药正在1月龄至60岁的SMA患者中进行临床研究。Risdiplam主要通过调节SMN2 RNA的剪接过程,增加能够产生正常SMN蛋白的mRNA的水平,从而缓解患者症状。据悉,这一治疗SMA的策略与已获批的Spinraza非常相似。不同之处在于,Spinraza使用反义寡核苷酸调节RNA剪接,需注射至脑脊液中,而risdiplam是一款可口服使用的小分子药物。
今年5月,罗氏旗下基因泰克(Genentech)宣布了两项临床试验最新结果,risdiplam不但可改善1型SMA患者的症状,还可以用于治疗2型和3型SMA患者。据悉,基因泰克计划将最新临床数据纳入向FDA和EMA递交的监管申请中,预计将在2019年下半年递交申请。
在中国,SMA治疗正迎来历史性变化
在中国,SMA疾病治疗在2019年发生了重大变化。2019年2月25日,渤健的Spinraza注射液(诺西那生钠注射液)正式在中国获批,给中国SMA患者带来了首款治疗药物。在此之前,SMA已被列入中国国家卫生健康委员会等部门联合制定的《第一批罕见病目录》,该目录的推出旨在支持罕见病的诊断和治疗。
除此之外,医药观澜查询中国药物临床试验登记与信息公示平台,上面针对SMA的临床研究有两项,均是由罗氏开展的临床研究。罗氏与合作伙伴正在对risdiplam,在1月龄至60岁的SMA患者中进行临床研究。据悉,中国也加入了关键性临床研究。

图片来源:药物临床试验登记与信息公示平台
我们很高兴看到,人类在与SMA的斗争中,取得了这些重大的、里程碑式的胜利。科学家的努力,让人类看到疾病不断被攻克。
对于SMA这样的罕见遗传病来说,基因检测、产前诊断等医学技术的应用,也让疾病筛查也越发普及,为人类预防和治疗奠定了坚实基础。此外,随着全球领域对创新疗法和罕见病药物研发的政策支持,相信会有越来越多的创新疗法面世,攻克更多遗传病,挽救更多患者生命。
“医药观澜”微信公众号,了解更多中国医药创新动态。
[1]Novartis announces FDA filing acceptance and Priority Review of AVXS-101, a one-time treatment designed to address the genetic root cause of SMA Type 1. Retrieved May 2, 2019, from http://investors.avexis.com/phoenix.zhtml?c=254285&p=irol-newsArticle&ID=2378942
[2]New SPINRAZA® (nusinersen) Data Unveiled at AAN Annual Meeting Show Continued Improvement in Motor Function for Broad Age Range and Survival Benefit for Infants
[3]脊髓性肌萎缩症(SMA)的前世今生.Retrieved Agu 15, 2019, from渤健生物官微
[4]遗传致病!每45人中就有1人携带这种缺陷基因.Retrieved Agu 7, 2019, from罗氏制药官微
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..