免疫肿瘤学新锐公司Elicio Therapeutics展示了其针对7种KRAS突变体(mKRAS)的癌症疫苗的重要临床前数据。数据结果表明,靶向mKRAS抗原的癌症疫苗能够诱发强效的细胞裂解。Elicio的“AMP KRAS疫苗”ELI-002项目预计将于2020年第一季度进入治疗胰腺癌患者的初步临床研究。
ELI-002包含7个mKRAS肽段。该疫苗接种后产生的免疫应答能够产生对KRAS蛋白突变体的强力免疫反应。此外,这一疫苗不但可以激活CD8阳性T细胞,还可以激发CD4阳性T细胞的反应。在体外用mKRAS特异性多肽再刺激时,可产生高水平的Th1辅助细胞因子。在体内,通过疫苗免疫应答产生的T细胞对表达mKRAS的靶细胞具有强大细胞裂解功能。此疫苗可覆盖99%携带KRAS基因突变的肿瘤。
胶质母细胞瘤之“烦恼”!肿瘤电场疗法获中国创新医疗器械认定
再鼎医药(Zai Lab)和Novocure公司宣布,肿瘤治疗电场(Tumor Treating Fields,TTF)产品Optune获得中国国家药品监督管理局(NMPA)授予的创新医疗器械认定(Innovative Medical Device Designation),用于治疗患有多发性胶质母细胞瘤(glioblastoma,GBM)的成人患者(22岁或以上)。
肿瘤治疗电场是一种低强度的交替电场,它可以影响细胞有丝分裂过程中特定细胞成分的运动,扰乱有丝分裂。由于肿瘤细胞在进行有丝分裂时的独特形状和特征,通过调节肿瘤治疗电场的交替频率,它可以有针对性地扰乱肿瘤细胞的分裂。Optune已经获得FDA批准治疗多发性胶质母细胞瘤。肿瘤治疗电场已经被纳入在2018年发布的《中国胶质瘤治疗指南》,并被推荐用于治疗新发GBM(1级证据)。

▲肿瘤治疗电场作用机理(图片来源:Novocure公司官网)
创新医疗器械认定可以让再鼎医药利用加快的审批程序,该程序提供了在整个审批过程中获得NMPA咨询和建议的机会。2018年9月,再鼎医药与Novocure达成肿瘤治疗电场在大中华区的独家授权许可协议。Optune此前已登陆美国、欧洲、日本等市场。Novocure公司的另一款肿瘤治疗电场设备NovoTTF-100L,在美国已经获得批准治疗恶性胸膜间皮瘤(MPM)。
挑战“不可成药”靶点!勃林格殷格翰布局KRAS抑制剂
勃林格殷格翰(Boehringer Ingelheim)公司和德克萨斯大学MD安德森癌症中心(UT MD Anderson Cancer Center)宣布达成一项新的多年合作,双方将共同开发多种创新抗癌疗法,其中包括治疗胃肠癌和肺癌的KRAS抑制剂。这并不是勃林格殷格翰第一次对KRAS表现出兴趣。两年多前,它就曾与范德堡大学(Vanderbilt University)的科学家合作,研究可以激活KRAS的SOS蛋白。
KRAS以前一直被认为是“不可成药”的癌症靶点,然而近年来,多家生物技术公司在KRAS抑制剂研发方面已经取得成果。就在几周前,安进(Amgen)公司的最新临床试验数据表明,其KRAS G12C抑制剂AMG 510不但能够在非小细胞肺癌(NSCLC)患者中产生疗效,也能为结直肠癌(CRC)患者和阑尾癌(appendiceal cancer)患者带来部分缓解。Revolution Medicines公司开发的KRAS G12C抑制剂能够抑制KRAS G12C与GTP结合的激活构象,从而可能具有更好的抑制效果。大型医药公司也加快布局KRAS抑制剂的步伐。诺华(Novartis)公司日前与Mirati Therapeutics公司达成临床试验合作,将评估其SHP2抑制剂TNO155与Mirati公司的在研KRAS G12C抑制剂MRTX849联合使用,治疗携带KRAS G12C突变的晚期实体瘤的效果。勃林格殷格翰的这一合作再度表现了业界对KRAS抑制剂前景的看好。
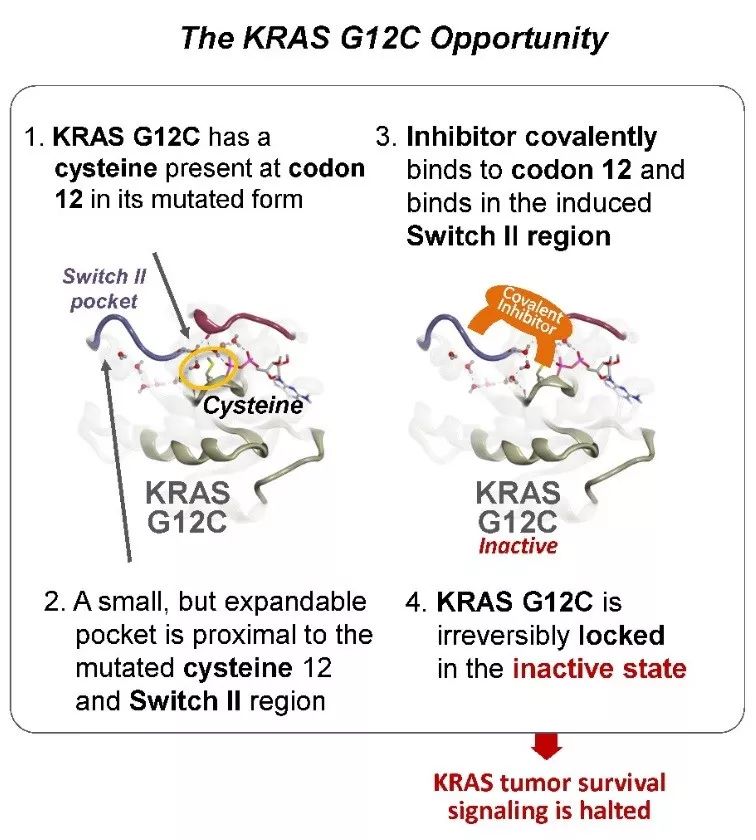
▲KRAS G12C抑制剂成药机制(图片来源:Mirati官网)
在勃林格殷格翰公司和MD安德森癌症中心的这项合作中,双方将联合建立虚拟研发中心,目的在于可以使各个组织之间有效共享和分析数据,进而开发包括KRAS抑制剂和具有选择性诱导癌细胞死亡潜力的TRAILR2抗体在内的潜在新疗法。这一关系的建立使双方研发项目在几年内可以进入不同的开发阶段,更好地结合MD安德森独特的患者驱动药物开发的潜力和勃林格殷格翰的新药研发能力。
降低癌症进展和死亡风险超八成!Ripretinib 关键性3期临床试验表现亮眼
Deciphera公司宣布ripretinib的关键性3期临床试验INVICTUS的积极顶线数据,ripretinib是一种KIT和PDGFRα抑制剂,用于治疗四线及四线以上的胃肠道间质瘤(GIST)患者。Deciphera公司预计在2020年第一季度向美国FDA递交ripretinib的新药申请(NDA)。
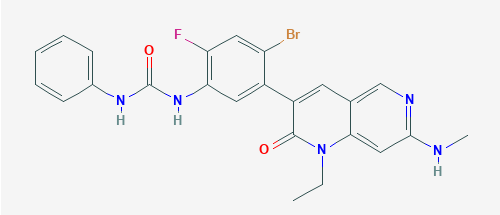
▲Ripretinib分子结构式(图片来源:PubChem)
Ripretinib是一种KIT或PDGFRα激酶抑制剂,现处于临床开发阶段,用于治疗KIT或PDGFRα驱动的相关癌症,包括GIST、系统性肥大细胞增多症(SM)等其他癌症。Ripretinib专门设计通过抑制KIT或PDGFRα的广谱突变来改善GIST患者的治疗。2019年6月,美国FDA授予ripretinib快速通道资格认定,用于治疗先前已接受过imatinib、sunitinib和regorafenib治疗的晚期GIST患者。Deciphera公司已与再鼎医药达成独家授权合作,以推进ripretinib在大中华区的开发和推广。
3期临床试验INVICTUS是一项随机、双盲、多中心、安慰剂对照的国际性研究,129名患者按照2:1的比例接受ripretinib或安慰剂的治疗,旨在评估ripretinib对于先前已接受过imatinib、sunitinib和regorafenib治疗的晚期GIST患者的安全性、耐受性和疗效。研究表明,ripretinib达到了改善患者无进展生存期(PFS)的主要终点,接受ripretinib治疗的患者的PFS为27.6周,而安慰剂组的PFS仅为4.1周,与安慰剂相比,使用ripretinib治疗的患者疾病进展或死亡风险降低了85%。
双喜临门!阿斯利康公布两项重要研发进展
阿斯利康(AstraZeneca)公布了两项重要研发进展。首先,该公司与默沙东(MSD)联合开发的重磅PARP抑制剂Lynparza(olaparib),与beviacizumab联用,作为一线维持疗法,在治疗晚期卵巢癌患者的3期临床试验中达到主要终点。值得注意的是,参加这一临床试验的患者不需考虑BRCA基因突变状态,这意味着Lynparza在为更广泛的癌症患者造福的道路上又迈进了一步。
同时,阿斯利康公司宣布,该公司的布鲁顿酪氨酸激酶(BTK)抑制剂Calquence(acalabrutinib),获得FDA授予的突破性疗法认定,作为单药疗法治疗慢性淋巴性白血病(CLL)成年患者。突破性疗法认定将加快这一差异性BTK抑制剂的研发和审评过程。
Lynparza是一款“first-in-class”PARP抑制剂,它靶向DNA损伤修复反应(DDR)通路,利用“合成致死“原理,在杀伤癌细胞的同时,不影响健康细胞。它于2014年12月首次被FDA批准,用于治疗携带BRCA种系基因突变的晚期卵巢癌患者,成为全球首个获批的PARP抑制剂。2018年8月,Lynparza(商品名利普卓)也在中国获批上市,成为首个在中国问世的卵巢癌靶向新药。
Calquence是一款BTK抑制剂,它通过与BTK共价结合,抑制它的活性。临床前试验表明,与“first-in-class“BTK抑制剂ibrutinib相比,Calquence具有对BTK更高的亲和力和特异性。它已经在2017年10月,获得FDA加速批准,二线治疗套细胞淋巴瘤(MCL)。
“攻克”高度耐药肺结核!创新抗生素获FDA批准
美国FDA宣布,批准由非盈利组织全球结核病药物开发联盟(TB Alliance)开发的pretomanid上市,与贝达喹啉(bedaquiline)和利奈唑胺(linezolid)联用,治疗特定高度耐药肺结核(TB)患者。这是近40年来FDA批准的第三款抗肺结核新药,也是第一款由非盈利组织开发并且上市的肺结核新药。
Pretomanid是一种新化学实体。它与贝达喹啉和利奈唑胺构成的组合疗法的疗效在名为Nix-TB的关键性临床试验中获得了证明。参加这一试验的109名患者包括广泛耐药性TB患者,和对已有疗法不耐受或无反应的多重耐药性患者。试验结果表明,在接受治疗6个月之后,这一组合疗法的成功率达到89%,显著高于治疗广泛耐药TB患者的历史成功率。
第三款“不限癌种”疗法来了!FDA加速批准罗氏Rozlytrek
美国FDA宣布,加速批准罗氏(Roche)开发的Rozlytrek(entrectinib)上市,治疗携带NTRK基因融合的成年和青少年癌症患者,这些患者没有其它有效治疗方法。这是继Keytruda和Vitrakvi之后,FDA批准的第三款“不限癌种”的抗癌疗法。它们靶向驱动癌症的特定基因特征,而不是肿瘤起源的组织类型。FDA同时批准Rozlytrek治疗携带ROS1基因突变的非小细胞肺癌患者(NSCLC)。
Rozlytrek是一款针对NTRK和ROS1基因融合而设计的特异性酪氨酸激酶抑制剂,它能够抑制TRK A/B/C和ROS1激酶活性。它已经于今年6月在日本首次获批上市,治疗携带NTRK基因融合的晚期复发性实体瘤患者。
这一批准是基于多项临床试验的结果,其中包括名为STARTRK-2的关键性2期临床试验,名为STARTRK-1和ALKA-372-001的1期临床试验。对这些试验数据的汇总分析表明,在NTRK融合阳性实体瘤患者中,Rozlytrek达到57.4%的客观缓解率(ORR),中位缓解持续时间(DOR)达到10.4个月。多达10种不同类型的实体瘤患者对这一疗法产生响应。
值得注意的是,对于肿瘤转移到大脑的实体瘤患者,Rozlytrek也能达到54.5%的颅内客观缓解率,获得缓解的患者中四分之一达到完全缓解。
拯救“睡不醒”!FDA批准“first-in-class”创新疗法
美国FDA批准Wakix (pitolisant)用于治疗成年发作性睡病(narcolepsy)患者的白日过度嗜睡 (EDS) 。Wakix是一款“first-in-class”的选择性组胺3(h3)受体拮抗剂/反向激动剂,通过一种全新的作用机制——增加大脑中促进觉醒的神经递质组胺的合成和释放——发挥作用。Wakix在早晨醒来后口服给药,每日一次。Wakix是首个也是唯一一个获得FDA批准同时未在美国被列为管制药物的发作性睡病新药。
此次获批基于两项多中心、随机、双盲、安慰剂对照研究(HARMONY 1和 HARMONY 1bis),评价Wakix治疗成年发作性睡病患者EDS的疗效。这些研究共入组261名患者,随机接受Wakix、安慰剂或阳性对照药物;患者的中位年龄分别为37岁(HARMONY 1)和40岁(HARMONY 1bis),治疗持续时间为八周。75%至80%的患者有猝倒病史。在这两项研究中,Wakix通过测量爱华睡眠量表(ESS)得分,证明了在 EDS方面有统计学意义上的显著改善。

Wakix是由Bioprojet公司研发,2016年在欧洲获批上市。Harmony拥有Bioprojet的独家授权,可以在美国开发、生产和商业化该药物。Wakix在2010年获得FDA授予治疗发作性睡病的孤儿药资格。
双星闪耀!艾伯维、新基第二代JAK抑制剂同获批
新基(Celgene)公司宣布,美国FDA批准高度特异性JAK2抑制剂Inrebic(fedratinib)上市,治疗成年骨髓纤维化(myelofibrosis,MF)患者。与此同时,艾伯维(AbbVie)公司宣布,FDA批准JAK1选择性抑制剂Rinvoq(upadacitinib)上市,治疗类风湿性关节炎患者。这两项批准标志着对JAK蛋白激酶家族具有选择性的第二代JAK抑制剂正式登场。
Inrebic(fedratinib)是一款口服JAK2和FLT3抑制剂,它能够抑制野生型和突变激活的JAK2蛋白激酶的活性。Inrebic是一种JAK2特异性抑制剂,对JAK2的抑制效果强于JAK1、JAK3和TYK2。已有研究表明,JAK2的异常激活与骨髓纤维化和真性红细胞增多症相关。在体外和动物试验中,Inrebic能够阻断STAT3/5的磷酸化,改善与疾病相关的症状。
Rinvoq(upadacitinib)是一款每日口服一次的小分子JAK1选择性抑制剂。除了治疗类风湿性关节炎以外,它还在多个炎症性适应症中进行临床研究,包括银屑病关节炎、克罗恩病、溃疡性结肠炎、强直性脊柱炎和特应性皮炎。
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..