在全世界范围内,耐药细菌的流行已经成为了严重的公共健康危机。很多人可能没有意识到,在目前的欧洲,每年由于耐药菌感染而死亡的患者人数已经相当于流感、肺结核以及HIV感染的死亡人数总和!据估计,倘若耐药菌的肆虐无法得到控制,30年后,每年被耐药细菌杀死的患者总数甚至要多于癌症!
面对这一兴起的全球健康危机,科学家们正期望从多方面解决问题:有些科学家希望能开发具有全新作用机制的新药,为人类带来新的抗菌武器;有的科学家则期望搞清细菌为啥能快速产生耐药性。
在今日最新出版的《科学》杂志上,来自法国的一支研究团队利用先进的显微成像技术,清楚地看到了耐药性如何在细菌之间“传导”。显微镜下的画面,像极了武林高手给后辈传授功力。
我们来具体看一下这项研究。首先,科学家们决定使用大肠杆菌来作为研究对象,而所测试的抗生素则为常见的四环素。先前已经有不少研究发现,耐药的大肠杆菌会在细胞膜上形成一种“解毒泵”,把有毒性的四环素从细胞内排出去,从而减少四环素对自身的杀伤。
可怕的是,这种耐药性“会传染”!科学家们将两种大肠杆菌混在一起培养,其中一种能被四环素杀伤,另一种则对四环素有耐药性。结果仅过了3个小时,就有70%的细菌从不耐药变为了耐药!
这是为什么呢?进一步的研究发现,为细菌“解毒”的泵,其DNA存在于细菌内的质粒上。这是一种小型的环状DNA,能够在细菌和细菌之间传递。也就是说,耐药细菌很有可能把自己的解毒秘诀通过质粒,“传授”给了没有耐药性的细菌。这解释了后者为啥能快速产生耐药性。
为了更好地了解耐药性产生的过程,研究人员们设计了一种精妙的荧光系统:在对四环素敏感的大肠杆菌里,他们加上了一种特殊的荧光蛋白。当带有“解毒泵”的质粒进入这些细菌时,这种特殊的荧光蛋白就会在进入的位置富集,产生几个小亮点,宣告“传功”的开始。
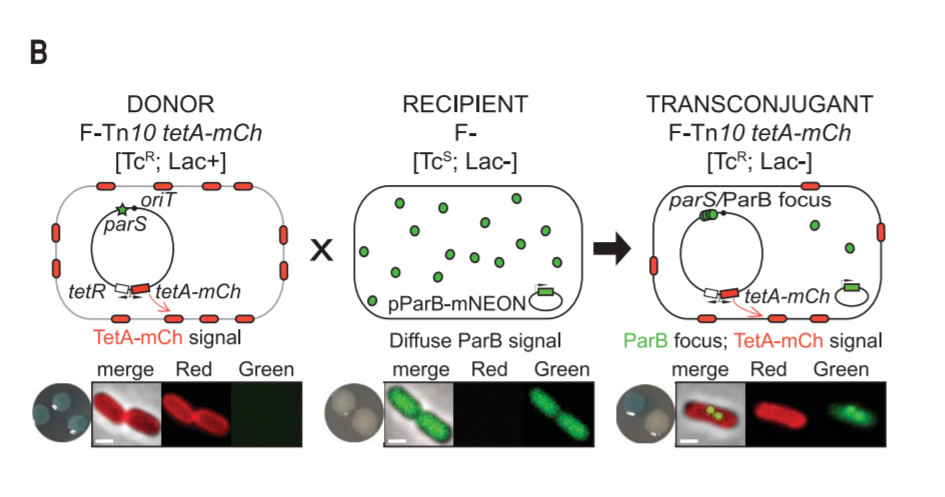
▲本荧光系统的图示(图片来源:参考资料[1])
而在负责“传功”的质粒上,研究人员们又添加了另一种荧光蛋白。一旦细菌开始表达这些“解毒泵”,就会相应发出荧光,彰显细菌“耐药武功大进”。
在这套荧光系统的帮助下,科学家们发现仅需1-2个小时,编码“解毒泵”的单链DNA就会在细菌体内变成双链DNA,然后快速翻译成蛋白质,为细菌带来四环素的耐药性。
这一发现虽然清楚地解释了细菌耐药性的产生,却也给研究人员们带来了一个巨大的谜团:四环素的作用机理正是抑制蛋白翻译,凭啥这些“解毒泵”还会快速合成?
进一步的探索回答了这一悖论:原来几乎在所有细菌里,都自带另一种叫做AcrAB-TolC的“通用解毒泵”。它不如“四环素解毒泵”那么有效,却也能将少量的四环素排出细胞外,让细菌得以保持最低限度的蛋白合成功能。一旦这些细菌遇上“传功”的耐药菌,还是可以合成“四环素解毒泵”,让自己持久耐药。
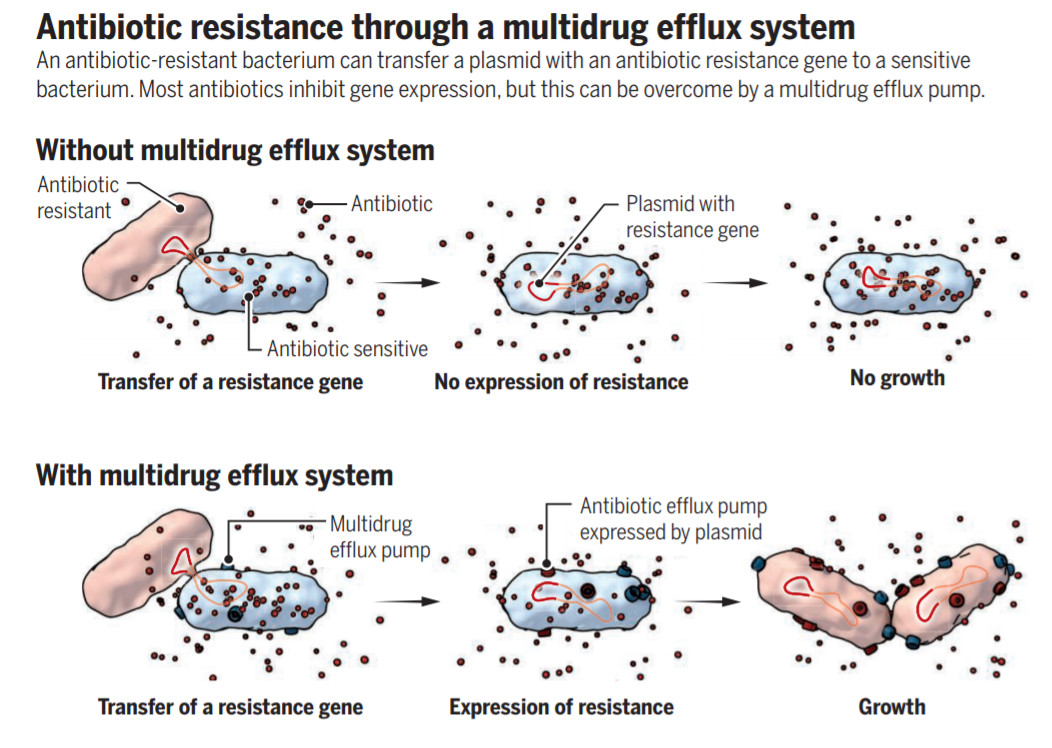
▲《科学》杂志为本研究做了专文评述,指出抑制“通用解毒泵”的重要意义(图片来源:参考资料[2])
研究人员指出,这个发现让我们对细菌的耐药性产生有了更新的理解。它不但让我们认识到了“通用解毒泵”的重要性,还了解了“四环素解毒泵”产生的时间可以有多短。“我们可以考虑一种组合疗法,将抗生素和‘通用解毒泵’抑制剂联合起来,”本研究的通讯作者Christian Lesterlin教授说道:“要预估这种抑制剂的临床应用还为时尚早,但考虑到能够减少抗生素耐药性,并预防耐药性传到其他种的细菌里,现在这一领域已经有大量的研究正在开展。”
我们期待有朝一日,科学家们能顺利找到阻断细菌“传功”的方法,杜绝耐药性的大规模爆发。
参考资料:
[1] Sophie Nolivos et al., (2019), Role of AcrAB-TolC multidrug efflux pump in drug-resistance acquisition by plasmid transfer, Science, DOI: 10.1126/science.aav6390
[2] Vanessa R. Povolo and Martin Ackermann, (2019), Disseminating antibiotic resistance during treatment, Science, DOI: 10.1126/science.aax6620
[3] The extraordinary powers of bacteria visualized in real time, Retrieved May 23, 2019, from https://www.eurekalert.org/pub_releases/2019-05/ind-tep052319.php
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..