一项小型临床试验表明,基因疗法能够安全纠正患罕见、致命遗传性疾病新生儿的免疫系统。8例X-连锁严重联合免疫缺陷病(X-SCID)患者接受了由NIH等机构科学家开发的基因疗法的治疗。试验结果显示,患儿的免疫系统功能得到了显著改善,且患者在接受治疗后正常生长了2年。这一里程碑式进展于4月18日发布在顶级医学期刊NEJM杂志上[1]。
“我们的基因疗法修复了患有X-SCID的婴儿广泛的免疫功能,这是前所未有的。”共同领导该研究的Harry Malech博士说。
X-SCID是一种只影响男性的疾病,也称泡泡男孩病,由IL2RG基因突变引起;患者抗感染免疫细胞未发育或功能异常,极易受到严重感染,因此需要对未经治疗的患者进行隔离。如果在出生第一年不治疗,这种疾病将致命。
目前,患有X-SCID的婴儿通常接受造血干细胞移植治疗,最理想的供体是基因匹配的兄弟姐妹。然而,只有不到20%患X-SCID的婴儿能够找到这样的捐赠者。没有匹配兄弟姐妹的X-SCID患儿通常接受来自父母或其它供体的移植,这虽然能挽救生命,但往往只能部分恢复免疫力。这些患者需要终身治疗。
为了更好地修复X-SCID患者的免疫功能,来自NIH国家过敏和传染病研究所(NIAID)和St. Jude儿童研究医院的科学家们开发了一种实验性的基因疗法,希望将正常拷贝的IL2RG基因插入到患者自身的造血干细胞中。
具体来说,研究人员首先从患者的骨髓中获取造血干细胞;接着一种不会导致疾病的工程化慢病毒被用作载体,将正常版本的IL2RG基因递送到患者的造血干细胞中;最后,携带正常版本IL2RG的干细胞被回输给患者。在接受回输前,患者接受了小剂量化疗药物白消安的治疗,这是为了帮助经过基因改造的干细胞在骨髓中定植,并开始产生新的血细胞。
代号为LVXSCID-ND的双中心、I/II期试验(NCT01512888)招募了8例年龄在2-14个月被新诊断为X-SCID的婴儿。这些患儿缺乏基因匹配的兄弟姐妹供体。
试验中位随访16.4个月。8例接受治疗的婴儿中有7例在基因治疗后的3至4个月内发育出正常数量的多种类型的免疫细胞,包括T细胞、B细胞和NK细胞。虽然另外1例参与者在首次回输后体内的T细胞数量依然很低,但在第2次回输基因改造过的造血干细胞后,T细胞数量大大增加。参与试验的所有患儿在治疗前经受的病毒和细菌感染在治疗后也得到了解决。
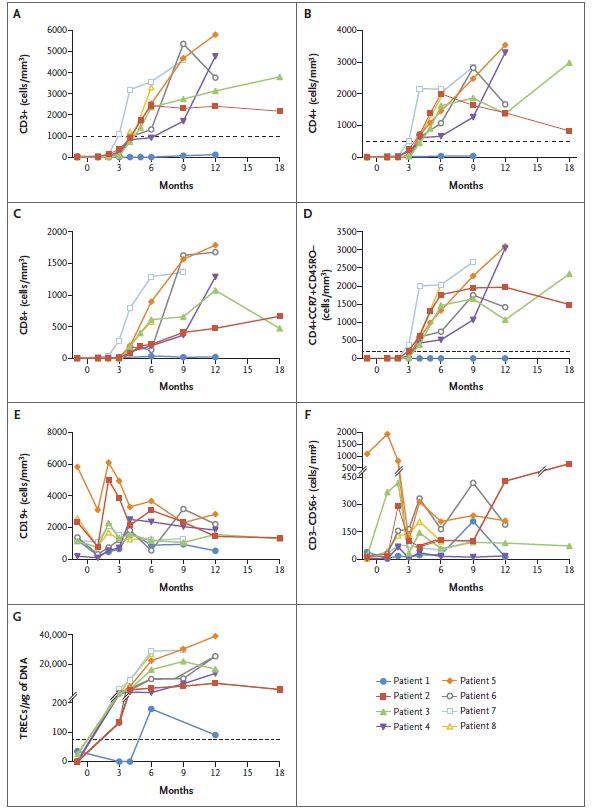
基因治疗后的免疫重建(图片来源:NEJM)
安全性方面,骨髓采集、白消安处理以及干细胞回输都没有产生意外副作用。尽管一些患者出现了预期内的副作用(如化疗后血小板计数低),但该基因疗法总体上是安全的。
事实上,用基因疗法治疗SCID并不新鲜,上个世纪90年代就有科学家开始了这方面的尝试。不过,之前的基因疗法有很多缺陷。
与先前测试的其它基因疗法(这些疗法使用了不同的载体或化疗方案)相比,这项研究中的疗法显得更安全、更有效。因为,利用其它基因疗法的早期研究中,患者的T细胞功能得以恢复,但其它关键免疫细胞(包括B细胞、NK细胞)的功能并未完全恢复。这项新研究中,患者不仅发育出了B细胞和NK细胞,其中还有4例患儿停止了静脉注射免疫球蛋白(注射抗体以增强免疫力)治疗。在这4例患儿中,又有3例能够响应儿童疫苗产生抗体,这表明,他们的B细胞功能强大。
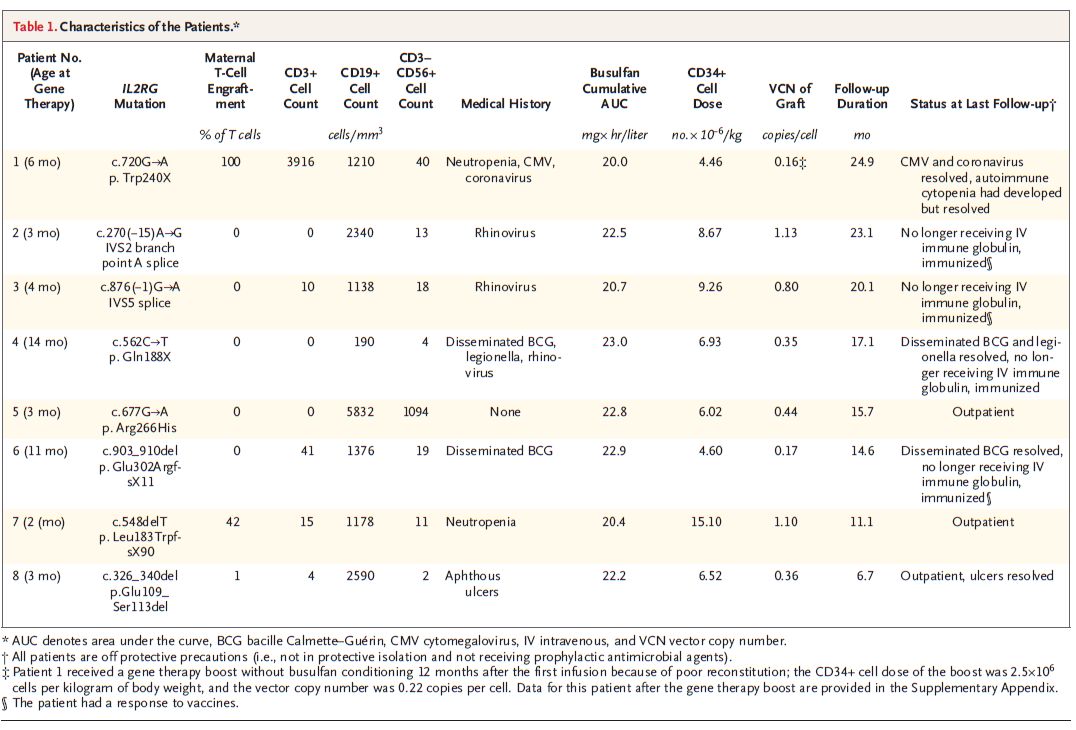
患X-SCID的婴儿可在接受基因治疗3-4个月后解除隔离,出院回家。(数据来源:NEJM)
美国国家人类基因组研究所的儿科遗传学家Charles Venditti认为,免疫细胞数量攀升至研究人员可以给一些病人接种疫苗的地步非常令人惊讶。
除了免疫功能修复不完全,一些早期基因治疗研究中的参与者在后来还患上了白血病。科学家们怀疑,这是因为使用的载体激活了控制细胞生长的基因。而当前这项研究中使用的慢病毒载体经过设计(给病毒载体加上一段所谓的绝缘体抑制对临近基因的影响),避免了这一问题。
总结来说,科学家们认为,慢病毒载体基因疗法联合低剂量化疗药白消安治疗新确诊患SCID-X1的婴儿在中位随访16个月期间,重建了功能性的T细胞和B细胞,恢复了NK细胞的数量,且急性毒性作用低。
NIAID所长Anthony S.Fauci表示,这些令人兴奋的新结果表明,对于患有X-SCID这种严重疾病的婴儿来说,基因治疗可能是一种有效的治疗选择,尤其是对那些缺乏干细胞移植最佳供体的婴儿。这一进展为他们提供了发育出功能完全的免疫系统的希望,以及过上健康生活的机会。
不过,这种基因疗法是否治愈了X-SCID患儿还需要更长时间的随访。科学家们正在继续监测接受慢病毒基因治疗的婴儿,以评估免疫重建的持久性以及治疗的潜在长期副作用,同时,他们正在招募更多的婴儿进入试验。此外,一项并行的试验正在评估该基因疗法在年龄较大的儿童以及年轻成人X-SCID患者中的疗效,试验(NCT01306019)也正在继续招募参与者。
St. Jude儿童研究医院已经将该疗法授权给名为Mustang Bio的公司。领导该研究的儿科血液肿瘤学家Ewelina Mamcarz博士表示,现在估计总成本还为时过早,但这类疗效将比目前的治疗方案更具成本效益,因为至少一些接受基因治疗的患者最终能够在不需要免疫球蛋白治疗或其它疗法的情况下保持健康。
图片来源:Nature Communications
除了这篇发表在NEJM上的成果,不久前(4月9日),斯坦福大学的团队也在Nature Communications 上[2]发表了用基于CRISPR技术的基因疗法治疗X-SCID小鼠的研究进展。
研究中,Matthew Porteus博士领导的团队改造了来自6例X-SCID患者的干细胞(可分化成免疫细胞):利用CRISPR/Cas9为细胞插入了健康拷贝的IL2RG基因。这些经过基因编辑携带正常版本IL2RG基因的干细胞被移植到SCID-X1小鼠模型中。结果显示,这些接受移植的小鼠能够产生免疫细胞,且治疗未带来可检测的副作用。此外,基因分析没有找到CRISPR产生脱靶效应(即,使非目标位置产生双键断裂,影响其它健康基因的功能)的任何证据。
研究人员表示,这是首次有研究证实,经CRISPR编辑的来自人类SCID-X1患者的干细胞能够成功用于在动物模型中制造免疫细胞。如果更大规模的小鼠研究取得成功,那么CRISPR-Cas9基因疗法将在未来1-2年内在人类患者中进行试验。
相关论文:
[1] Ewelina Mamcarz et al. Lentiviral Gene Therapy Combined with Low-Dose Busulfan in Infants with SCID-X1. NEJM(2019).
[2] Mara Pavel-Dinu et al. Gene correction for SCID-X1 in long-term hematopoietic stem cells. Nature Communications(2019).
参考资料:
1# Gene therapy restores immunity in infants with rare immunodeficiency disease
2# Gene Therapy Effective for Severe Combined Immunodeficiency
3# Scientists use CRISPR for possible 'bubble boy' therapy
4# SCID-X1体外基因疗法显示惊人疗效
关于召开第七届七次理事会暨会长办公会
各相关单位: 经研究,四川省医..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..