各相关单位:
《药品生产质量管理规范》已于2010年10月19日经卫生部部务会议审议通过,已于2011年3月1日起施行。新版GMP规范附录中对无菌药品生产的要求有大幅提高,增加了针对无菌生产风险控制的技术要求,特别强化了企业对无菌生产操作、环境控制与检测、灭菌与除菌工艺研究、无菌检测等无菌生产的关键环节的管理。
为了进一步帮助我省无菌药品企业学习、理解、把握、实施新版GMP无菌药品部分的内容,顺利实施过渡,应各会员单位要求,我协会拟为我省制药企业组织新版GMP及无菌药品附录实施学习活动,特邀请新版GMP起草小组成员、参与无菌药品附录及指南编写的专家、资深GMP检查员与资深的质量管理实际工作者,针对无菌药品生产过程中的一些重点、难点问题进行讲解,帮助无菌药品生产企业更好地学习理解新版GMP对无菌药品的要求及实施要则。本次学习相关安排如下:
一、参加对象
无菌药品企业负责人,生产部门负责人,质量管理部门负责人,技术部、工艺部技术人员,车间主任,质量保证,质量检验主管等。
二、学习内容
1、无菌药品生产环境设计与改造
2、无菌药品设备管理
3、无菌药品生产管理
4、药品质量风险管理现代发展趋势与我国新版GMP的实施要求
5、无菌药品生产灭菌控制
6、无菌药品工艺验证、清洁验证
7、供应商的审计(原料、辅料、包装材料)
8、药品质量管理(QA部分)
9、质量控制实验室管理(QC部分)
10、药品投诉与不良反应
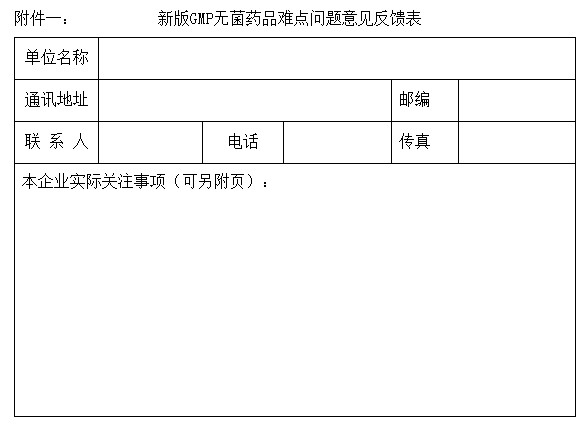
三、为了提高学习的针对性,请各参与单位认真准备在自学新版GMP各部分内容遇到的难点和问题,并于2011年4月26日前梳理反馈至我会秘书处,以便提供给教员作针对性解答。(见附件一)
四、时间及地点
报到日期:2011年5月18日9:00-17:00
学习时间:2011年5月19日-21日(共三天)
培训地点:成都市新华大道三槐树路2号(军转大厦)
报名截止日期:2011年5月15日(培训当日报名,恕不保证座位)
五、费用
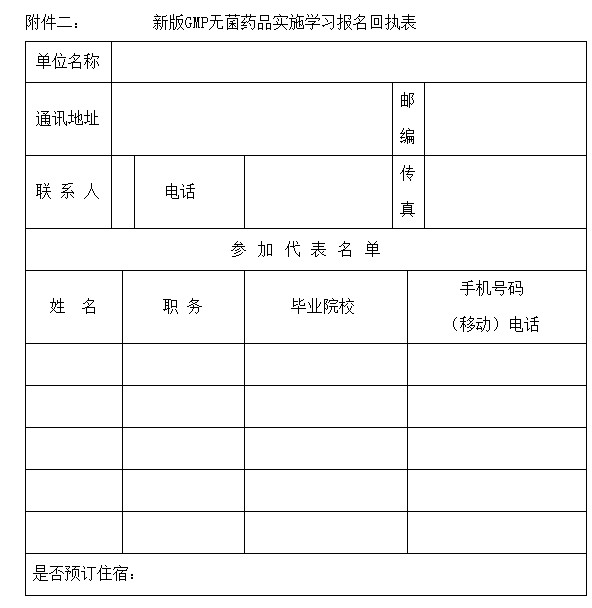
参加代表须交学习费:会员单位900元/人、非会员单位1200元/人(含资料、午餐)。协助安排食宿,费用自理,填好回执请于2011年5月15日前以传真或网上邮箱方式将回执发至四川省医药质量管理协会秘书处(见附件二)。
六、学习结束后,由四川省医药质量管理协会颁发本次学习结业证书。
七、联系方式
电 话:028-86919092
传 真:028-86919092
邮箱:scyyzx@163.com
网址:http://www.rrrry.com
联 系 人:蔡老师雷晓梅
四川省医药质量管理协会
二0一一年四月十二日