作者:蒲公英 来自:蒲公英
有一个很具体的问题,在蒲公英小五班微信群讨论的热火朝天,虽然最后也没有明确结论,但给我们带来一些思考:同样一个情景下,同样一个问题,不同的企业人员,不同的GMP检查员,给出了不一样的解释和结论,对同一件事情产生不同理解的根源在什么地方?
问题描述:
大容量注射剂,在同一配液罐里的药液是否可以同时用两台灌装机同时灌装,然后用同一个灭菌柜灭菌?
基于此问题,补充2个条件:
1、灌装的产品是同一个规格。
2、灌装的设备是同样的设备。
我没有任何大输液的生产经验,也不熟悉大输液的流程,但是从逻辑上理解,我觉得可以从下面几个方面进行分析:
1、符合GMP法规
GMP附录一《无菌药品》第六十条,关于无菌药品批次划分的原则(一)
大(小)容量注射剂以同一配液罐最终一次配制的药液所生产的均质产品为一批,同一批产品如用不同的灭菌设备或同一灭菌设备分次灭菌的,应当可以追溯。
根据这一条款理解:上述问题来自于一个配液罐,符合批次要求,也进行了灭菌,也是同一设备灭菌,唯一的区别在于“一配二”,即两台同样的灌装机后,进入同一个灭菌柜灭菌。
那么,关注的焦点应该就在于:1、两台灌装机的灌装量,灌装结果是否能够一致?2、每一个灌装机出来的,是否还具有可追溯性?
先说灌装机的一致性:两台灌装机来自同样的厂家、同样的规格型号....什么都是一样的,而且也应该经过DQ/IQ/OQ等各种Q的测试,理论上肯定是这些Q都被认可合格了才能进入正式生产,所以,是不是可以认为两台设备的一致性是符合要求的?(当然,为了验证而验证,编造数据的另当别论)
再说灌装后的追溯性:既然是灌装之后进入灭菌,应该是输液已经进入包装了,不同的灌装机通过辨识标示,解决追溯,也不是问题。
听起来,好像符合GMP啊,为什么符合GMP,还会有各种各样不同的理解呢?当然,符合GMP仅仅是最低标准,更多还是要从风险上去评估分析。
有人说:要亚批管理,并在灭菌时能有效区别。
有人说:只要能追溯,上面做法完全没问题。
有人说:我们公司就是这么做的,两台软袋灌装同时,一台上面印A,另一台印B。
有人说:即使你做过验证了,两台设备也可能会有差异的。
还有人说:就怕检查员尺度不一样,你和A检查员探讨同意,但是B来了不同意,企业还是死。
更多探讨,观点各异,最后似乎还是落在:最好到当地省局咨询一下,看看监管部门老师怎么说?(其实:监管部门一般不会告诉你行或者不行,所以也很难问到您想要的答案)
针对这个问题,我也好奇询问了几个专家和检查员,不同的人给了不同的理解:有人说行,有人说不行,还有人说不建议这样做。看似简单的问题,还挺复杂;说是复杂的问题,似乎又很简单。
我相信,很多制药企业都会面临很多类似的情况,一个很具体的问题,因为对GMP和风险的理解不同,检查员的尺度不同,会产生不同的结果和要求,这些问题,在现实中困扰着很多的企业,也值得我们思考:同样一个GMP,同样的情景,为什么会产生那么多的“不同理解”,问题的根源到底在哪?
再回到问题本身,不管企业是出于何种原因和目的,没有一对一的进行灌装,但现实情况已经这样,企业一定也为此问题产生困扰,符合GMP条款,仅仅是最低要求,所以无论行还是不行,风险在哪里,风险有多少?还求各位有实践经验的专家留言给予指点。
以下是摘自论坛部分回复:


其设计两台灌装机进行灌装的目的不得而知,撇开追溯问题不谈,厂房设计和生产管理的难度都已经很大了,如果再加上追溯难度就会更大。不知道他们的批量到底有多大,目前一台灌装机的应该可以满足生产需求。另外工艺管道的设计要求也不简单。整体来看还是不采用的好。如果已经没办法回头,这个车间的主任不好做,管理不到位确实会带来许多问题。
至于是否做亚批管理,个人认为还是有必要的,万一产品出现异常,我们可以追溯是哪台设备造成的,便于生产的改进和优化,同时可以将成本降到最低。做亚批的目的是针对有异常情况的。
鱼骨图单独帖上来:
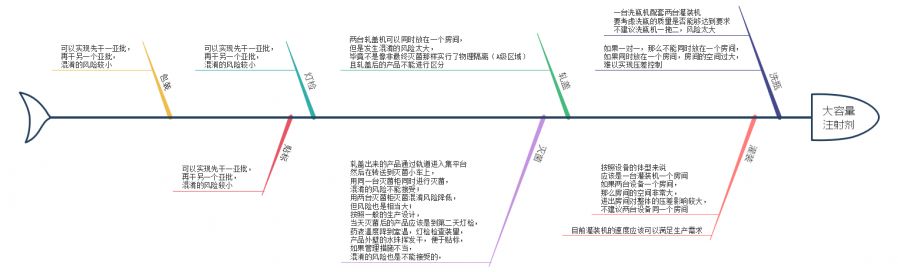
同学丙的观点:
以下针对合——分——合的说法,亚批之后不再合批实际上就是两个批号管理了,很多问题也就不存在了。
GMP中对批定义选择以终混作为划分,隐藏在背后的是批内产品质量属性的一致性,从这个角度来说,多个灌装机即使是相同的、验证的,无疑是不利于批次的产品一致性的,如果两台可行,三台呢,更多台呢?虽然实际很难遇到,但是理论上就很难回答清楚。其次,这种操作让过程变复杂了,增加了人为差错的可能性,比如标识、亚批批号管理、中控测试、留样等。最后,生产运行的管理是否也有影响?比如得率、物料平衡的计算和解释等。
我比较认同虽然看似不违背GMP,但GMP是最低要求,而不是最高要求,从避免混淆、差错,保证产品质量一致性的角度来说,这不是应当提倡的。个人看法。
同学丁的观点:
1.如果从灌装机分开按亚批生产,那后续的灭菌、灯检、包装按亚批管理风险比较小,可以分开时段或区域管理;
2.如果分装按亚批,灭菌等步骤合起来,那企业就应考虑两台灌装机使用过程的不一致而导致的整批产品放行,而不能按亚批放行。罐装过程还是有很多差异,如罐装机故障、气密性、终端滤芯的安装等
同学X的观点:
困境还是在于检查员的GMP风险管理认知深度!所企业在做某项工作时,第一考虑的不是交件事本身对产品质量风险,而是把检查员会怎么看这个事当成了最高风险。
同学H的观点:
有实践经验的专家怎么看不重要,关键是检查员怎么看
同学D的观点:
两台设备肯定存在差异,但经过验证这种差异是可以接受的,两台设备生产出来的产品印有袋码是能完全区别的。国内大型输液企业都是一个配制罐带两台,三台印刷制袋灌装一体机,没听说谁被否决了。
同学W的观点:
如果AB灌装机用红绿盖区别,灭菌用同一台设备没事,在最后包装之前,建议用分拣机分出红盖绿盖产品分别包装,实现亚批的管理。谁让你灌装机一开始就不匹配呢,总要为最初的不当设计付出代价
同学L的观点:
我也没搞过大输液,但上述风险考虑是没问的。我们倒退一下生产,生产结束后会出现三种结果,一、生产结束后,再做相关硬件确认时,发现某一条线出现了问题,异常情况。二、生产结束设备未出现问题,检验出现了问题,异常情况。三、生产设备未出现问题、检验未出线问题,上市销售出现了不良反应。基本差不多吧!
如果是我管理的话,通过概率或人为分析,包括成本考虑,只有出现上述问题,整批销毁或者召回。如果分成亚批管理的话,只销毁或召回亚批即可。
我的主观点是不建议两台灌装机和实现亚批管理。
不建议的理由:我只见过一条玻瓶输液生产线,所有的想法就是基于这条线的实际情况给予的,说实话两台灌装机,我不知道他要生产什么样的产品,多大规格,灌装机的能够达到什么样的速度、配液罐是多大的,但是要是施行亚批管理,洁净区的空间会相当大,压差控制其实都是一个头疼的问题,为了包装亚批管理,一般区的空间也要足够,真到实际生产的时候,有可能控制不住混淆。
而且两台灌装机对应几台洗瓶机,如果一台的话,洗瓶的质量都存在风险,如果两台洗瓶机,那么洁净区的空间还会加大,想想满脑子汗,洗瓶机的速度越快,洗瓶的质量越是个问题,而且大容量注射剂未清洗的玻瓶实际上还是满脏的。
专家检查也是考虑生产过程中的产品安全性的问题,如果这么考虑或管理应该就符合和监管要求了吧。我肯定就属于前者,按整批考虑,不然后续管理太麻烦,成本太高,检验成本增加,包装、销售、发运都是问题,但出现的概率很小。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..