来源:医药魔方
过去二十年,中国医药市场凭借医改推进和医保扩容,从只占全球的2%一跃成为仅次于美国的全球第二大医药市场。从市场销售规模看,仿制药占近80%。但随着仿制药一致性评价、带量采购等政策的开展,仿制药的发展空间越来越窄。与此同时,大量科技创新人才的回国、资本的注入与国家新药审评审批制度的完善,为创新药行业创造了空前的发展机遇。纵观中国近十余年的新药审评审批政策,经历了以下几个阶段的发展:
政策探索期:2007年前,中国创新药发展的相关政策正处于探索期,虽然获批上市的产品较多,但是标准尚未统一,质量参差不齐;
审批规范期:自2007年《药品注册管理办法》明确了新药的定义后,中国批准上市的新药要求更加明确、规范和严格; 药审改革期:2015年药审改革开始,将新药定义由“未曾在中国境内上市销售的药品”调整为“未在中国境内外上市销售的药品”,回归了“新药”的真正内涵,对新药的研发提出了更高的要求;2016年实行优先审评政策后,在2017年进口的新药数量达到36个,创下新高;截止至2018年11月6日,中国批准上市的新药已经达到23个(如图1)。 
中国上市的创新药数量呈逐步上升趋势,主要得益于以下3个因素:1)本土药企研发实力增强;2)进口新药进入门槛降低;3)政府审批速度加快。
壹
中国本土药企通过
自主研发和项目引进推进新药上市
经过多年的积累,中国制药企业的创新能力从原料药、低端制剂到高端制剂、me too、me better、mebest一步步进阶,虽然低水平重复还比较多,整体创新水平不高,但崛起之势已经不可避免。 一方面,愿意在研发上投入的国内药企越来越多。国内处于研发第一梯队的几家上市药企的研发投入在公司营收中的占比越来越高;一些新兴药企也正顺应医药创新的潮流迎头赶上,专注于创新药的研发(如图2)。不断增加的对外许可产品也是国内药企的自身研发实力得到认可的证明。据魔方咨询统计,2013-2018年中国药企对外许可药品数量共37个(截止2018年9月)。
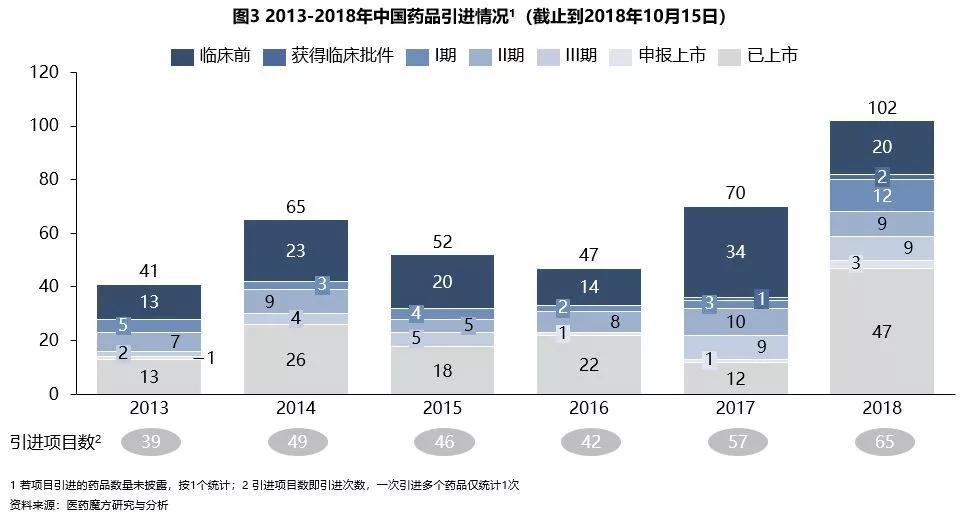
另一方面,在医药研发的全球化趋势影响下,除了增强自主研发能力,与跨国企业合作则是快速充实产品线、加快药物研发速度的有效方法。经医药魔方统计,中国医药项目引进数量逐年递增(如图3),本土药企通过进行对外合作,正在融入全球市场。 中国正融入全球市场 新药审批速度提高 2018年7月27日,国家药品监督管理局发布《关于调整药物临床试验审评审批程序的公告》,药物临床试验审评审批制度正式由审批制变为到期默认制。申报药物临床试验,自受理缴费之日起60日内,未收到药审中心否定或质疑意见的,申请人可以按照提交的方案开展临床试验。这一制度有利于降低企业成本,节约审批时间,也使中国临床试验申请实现了与美国、日本等施行到期默认制的发达国家接轨。 此外,审评员数量不足也是CDE审评效率低下的一重要原因。为解决新药审评审批积压问题,CDE从2015年开始扩招,审评团队已经从100多人增加到800多人。同时,CDE也正逐步筹划建设多学科综合审评的专业审评团队,将更有信心面对2018年完成积压临床试验申请的审批工作、实现各类注册申请按规定时限审批的挑战,到2020年建成一支专业齐全、配置合理、适应医药产业发展和重大新药创制需求的审评科学家队伍。 相信未来几年在本土药企、进口新企业和政府的共同努力下,中国上市的创新药数量必定如雨后春笋般大量增加。 
贰
外企新药进入中国市场的门槛逐渐降低,
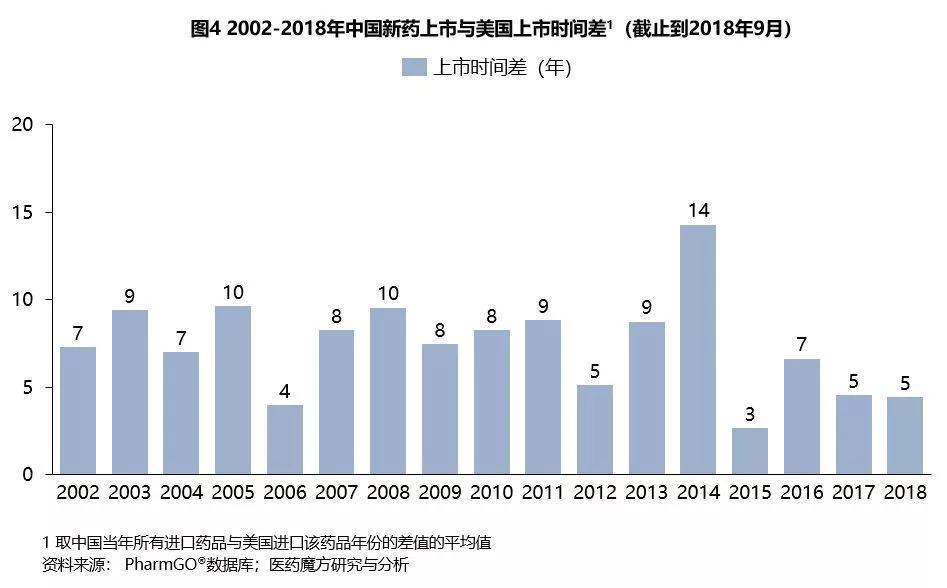
近年来,中国新药上市速度明显加快。取同一药品,与美国相比,中国进口该药的时间差正在逐渐缩小,在二十一世纪初期,中国与美国时间相差十年左右,2015年后时间差缩短至五年(如图4)。对于近两年上市的新药,中美上市的时间差更是被缩短一两年,甚至几个月。例如,2016年9月被列入优先审评名单的泰瑞莎,在2017年3月获批,仅晚于美国1年4个月;近期上市的肺癌新药安圣莎,在欧美获批9个月后获得中国国家药品监督管理局批准,基本实现境内外同步。
此外,2017年6月,中国正式加入ICH,意味着中国的药品监管部门、制药行业和研发机构将逐步转化和实施国际技术标准和指南,并积极参与规则制定。这有助于促进创新项目国际合作与转让,进一步推动国际创新药早日进入中国市场。而接受境外临床数据申报,不仅可以减少临床试验的重复和浪费,加快临床试验进程,有利于降低药品上市成本和价格,还会助力我国的药品审评审批制度改革,更好地推动药物研发创新。
政府推进审评审批改革,
2015年8月,国务院印发《关于改革药品医疗器械审评审批制度的意见》,提出提高药品审评审批标准,简化药品审评程序,加快药品审评速度,提高药品审评效力,正式拉开了以“解决注册申请积压”为目标和“改进药品临床试验审批”为主要任务的改革序幕。经魔方咨询统计,2015年后,国产新药临床试验审批时间逐步缩短,进口新药上市申请速度也呈现出越来越快的趋势(如图5)。
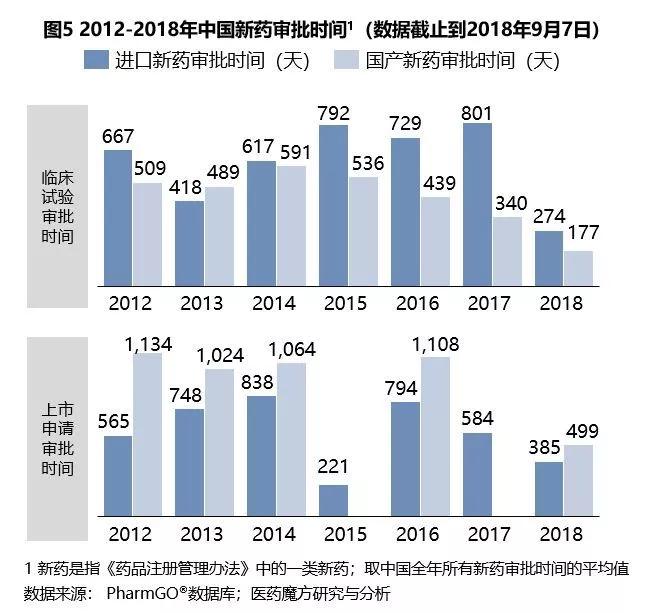
优先审评制度和临床试验申请到期默认制是政府加快审批速度的两大举措。2017年底国家出台了《关于鼓励药品创新实行优先审评审批的意见》,对具有明显临床价值等3大类、18种情形的创新药和临床急需、市场短缺药品优先审评审批;还研究制定了《临床急需药品有条件批准的技术指南》,对早期临床试验显示疗效的药品,可附条件批准上市。例如,九价HPV疫苗和治疗丙肝的第三代产品索磷布韦、维帕他韦片等药品纳入了优先审评审批通道,加速进入中国。
认真落实巡视组反馈意见,进一步规范协
按照四川省市场监督管理局党组巡视..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于召开会长办公会的通知
各会长、副会长单位: 根据四川..四川省医药保化品质量管理协会组织召开
2025版《中国药典》将于2025年10月..四川省医药保化品质量管理协会召开第七
四川省医药保化品质量管理协会第七..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..学习传达中央八项规定精神专题会议
2025年4月22日,协会党支部组织召..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..