|
值得注意的是,这已经是Opdivo被授予的第6个突破性疗法认定。官网消息还称,截止到目前,Opdivo临床开发项目已经招募了超过18000名患者,已在53个国家获得监管批准。
|

近几年,免疫检查点阻断疗法飞速发展,在多种癌症类型中取得了惊人的治疗效果,现已成为最前沿的癌症免疫疗法之一。截止到目前,FDA已批准了4个免疫检查点抑制剂,分别为CTLA-4单抗Yervoy(ipilimumab)、PD-1单抗Opdivo(Nivolumab)& Keytruda(Pembrolizumab)以及PD-L1单抗Tecentriq(Atezolizumab)。
BMS与默沙东的这两款PD-1抗体可谓是“老对头”,从目前的适应症获批情况和销售业绩来看,Opdivo依然更胜一筹。自2014年以来,Opdivo已先后获FDA批准用于治疗晚期黑色素瘤、肺癌、肾癌和经典型霍奇金淋巴瘤(Classical Hodgkin Lymphoma ),而Keytruda目前在FDA“拿下”的适应症包括黑色素瘤和非小细胞肺癌。
根据两家公司去年的年报和2016年一季报显示,Opdivo 2015年全年销售额达9.42亿美元,Keytruda同期销售额为5.66亿美元;Opdivo今年第一季度的销售额达到了7.04亿美元,而Keytruda同期销售额为2.49亿美元。据Fiercebiotech报道,BMS宣称,Opdivo已赢得了美国和其它主要市场超过80%的PD-1支出份额。
膀胱癌战场:罗氏领先,BMS紧跟

今年5月18日,罗氏的Tecentriq提前四个月获得FDA批准,率先拿下膀胱癌适应症,成为全球首个上市的PD-L1单抗;作为二线药物,用于治疗局部晚期或转移性尿路上皮癌(最常见类型的膀胱癌),适用于含铂化疗药物治疗期间或治疗后病情恶化的患者,或 12 个月内接受过含铂类药物化疗的患者。
然而,罗氏想独占这块“蛋糕”,可不是容易的事。6月27日,BMS官网消息,Opdivo已获FDA授予治疗晚期膀胱癌的突破性疗法认定(Breakthrough Therapy Designation),具体适应症为含铂化疗期间或化疗后病情进展的不可切除的局部晚期或转移性尿路上皮癌。BMS称,未来几个月内将基于II期研究CA209-275的数据向FDA申请Opdivo的膀胱癌适应症。
在不久前举办的ASCO上,罗氏与BMS纷纷公布了各自抗体治疗膀胱癌的数据。其中,罗氏公布了Tecentriq的一项II期临床研究数据有望支持其成为一线治疗药物。该试验中,Tecentriq治疗的患者有24%肿瘤缩小,在PD-L1高表达的患者中这一数据高达28%。响应Tecentriq治疗的患者中有3/4在平均随访14.4个月后并没有观察到癌症恶化;7%的患者获得完全缓解,显示没有疾病迹象。
而BMS也公布了Opdivo治疗含铂化疗后病情进展的转移性尿路上皮癌的首批数据。Opdivo降低了24.4%转移性膀胱癌患者的肿瘤负荷。这一I/II期临床试验治疗了78位病人,5人完全缓解(6.4%),14人部分缓解(18%),22人病情稳定(28.2%),30人病情进展(38%)。
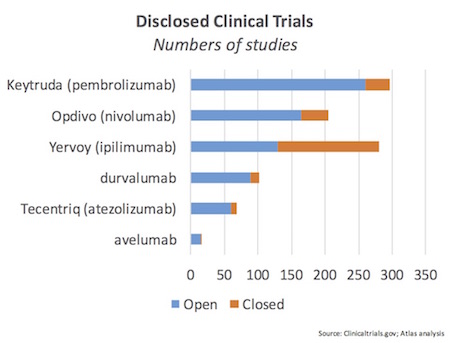
图片来源:Life sci vc
6个突破疗法、超18000名患者、53个国家
值得注意的是,这已经是Opdivo被授予的第6个突破性疗法认定。除了已获批的4个适应症及膀胱癌,今年4月,FDA已授予Opdivo用于治疗后复发性或转移性头颈部鳞状细胞癌的突破性疗法认定。
官网消息还称,截止到目前,Opdivo临床开发项目已经招募了超过18000名患者,已在53个国家获得监管批准。此外,除已获批的产品,BMS也在开发治疗癌症的其它免疫系统通路,包括CTLA-4、CD-137、KIR、SLAMF7、PD-1、 GITR、CSF1R、 IDO以及 LAG-3。
备注:本文部分内容参考自Fiercebiotech、BMS官网。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..