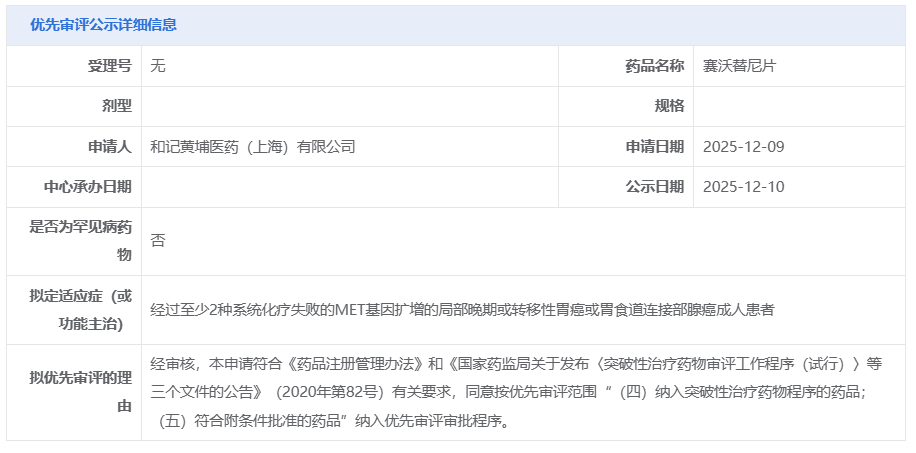
12 月 10 日,CDE 官网显示,和黄医药申报的赛沃替尼新适应症拟纳入优先审评,适应症为:经过至少 2 种系统化疗失败的 MET 基因扩增的局部晚期或转移性胃癌或胃食道连接部腺癌成人患者。
截图来源:CDE 官网
赛沃替尼是一种强效、高选择性的口服 MET TKI,由阿斯利康与和黄医药联合开发,并由阿斯利康负责商业化。MET 是一种受体酪氨酸激酶,在细胞的正常发育过程中发挥重要作用。赛沃替尼可阻断因突变 (例如外显子 14 跳变或其他点突变)、基因扩增或蛋白质过表达而导致的 MET 受体酪氨酸激酶信号通路的异常激活。
赛沃替尼是中国首个获批的选择性 MET 抑制剂,此前已在国内获批多项适应症,包括:单药用于 MET 外显子 14 跳变的非小细胞肺癌(NSCLC)成人患者;以及联合奥希替尼(阿斯利康开发)用于治疗 EGFR 基因突变阳性且经 EGFR-TKI 治疗后进展的伴 MET 扩增的局部晚期或转移性非鳞状 NSCLC 患者。
本次拟优先审评的申请针对的是一项新适应症:MET 基因扩增的局部晚期或转移性胃癌或胃食道连接部腺癌成人患者。此前,CDE 已将该适应症纳入突破性治疗品种。
2023 年 AACR 上,和黄医药曾公布了赛沃替尼针对 MET 扩增胃食管交界处/胃癌患者的 II 期研究 (NCT04923932) 的中期分析结果。数据显示:
经独立审查委员会确认的 ORR 为 45%,而在高 MET 基因拷贝数的患者中 ORR 为 50%。4 个月时的缓解持续时间率为 85.7%,中位随访时间为 5.5 个月。
最常见的 3 级或以上治疗相关不良事件为血小板数量降低、过敏、贫血、中性粒细胞减少及肝功能异常。只有 1 名患者因 4 级肝功能异常 (治疗相关不良事件) 停止治疗,没有患者因治疗相关不良事件死亡。
根据 Insight 数据库,这项中国 Ⅱ 期研究已于今年 4 月完成患者招募,预计将于 2026 年 12 月完成。和黄医药此前曾在新闻稿中表示,如果该研究取得积极结果,其将于 2025 年年底在中国启动递交赛沃替尼用于治疗胃癌的上市许可申请。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..