2025年11月14日,NMPA官网显示,罗氏制药阿替利珠单抗皮下注射剂型的上市许可申请已获批准。作为国内首个获批的进口PD-L1皮下注射剂,该药物的上市将显著改善患者治疗体验,优化医疗资源配置,标志着中国肿瘤免疫治疗进入更便捷、高效的新阶段。
阿替利珠单抗自2016年在美国首次获批以来,已成为全球肿瘤免疫治疗的重要药物,覆盖非小细胞肺癌、小细胞肺癌、肝细胞癌、黑色素瘤、尿路上皮癌、三阴性乳腺癌和腺泡状软组织肉瘤七大癌种。此次皮下注射剂型的获批,将进一步拓展其临床应用场景。

图1. 阿替利珠单抗皮下注射剂国内获批上市,来源:NMPA官网
1
从静脉输注到皮下注射
阿替利珠单抗皮下注射剂型采用Halozyme Therapeutics公司的Enhanze药物输送技术。该技术基于重组人透明质酸酶PH20,可局部、暂时降解透明质酸,增加皮下组织渗透性,为单克隆抗体提供分散空间,促进药物快速吸收进入血液循环。
与传统静脉输注相比,皮下注射在给药时间上实现质的飞跃:静脉输注需30-60分钟,而皮下注射仅需约7分钟。这不仅显著缩短患者在院时间,减轻治疗不适感,也提升了整体治疗体验。
从药物学角度看,Enhanze技术确保皮下注射与静脉输注在药代动力学特征上高度一致,为其他大分子药物的剂型改良提供了重要借鉴。
2
关键临床研究情况
该剂型的获批基于全球多中心随机Ib/III期IMscin001研究。研究纳入371例既往铂类治疗失败的局部晚期或转移性非小细胞肺癌患者,比较了皮下注射与静脉输注的药代动力学、安全性和有效性。
结果显示,皮下注射与静脉输注在药代动力学方面具有可比性:血清谷浓度几何平均比率为1.05,模型预测曲线下面积为0.87,均在预设等效范围内,表明皮下注射能提供与静脉输注相当的药物暴露水平。
疗效方面,皮下注射组和静脉输注组的中位无进展生存期分别为2.8个月和2.9个月,客观缓解率分别为11.8%和9.7%,显示相似的抗肿瘤活性。安全性特征一致,两组不良事件发生率相当,未发现新的安全性信号。
研究数据充分证明,皮下注射在维持原有疗效和安全性的同时,为患者提供了更便捷的治疗选择。全球多中心试验设计保证了结果的可靠性,为临床应用提供了坚实依据。
3
患者偏好与治疗体验提升
罗氏开展的IMscin002研究专门评估了患者对皮下注射和静脉输注的偏好。该研究纳入179例患者,结果显示超过70%倾向于选择阿替利珠单抗皮下注射剂型,85.8%的患者对皮下注射表示满意。
患者偏好转变主要源于多方面改善:治疗时间缩短,减少在院停留;降低治疗不适感,避免静脉穿刺并发症;提高治疗可及性,为院外治疗创造可能。
治疗便利性的提升对需长期免疫治疗的肿瘤患者尤为重要。简化流程不仅减轻患者身心负担,也有助于提高治疗依从性,从而可能改善长期疗效。
4
行业发展趋势与竞争格局
随着众多PD-1/L1抑制剂专利到期临近,开发新型给药方式已成为制药企业延长产品生命周期的重要策略。皮下注射正成为后PD-1/L1时代的主要竞争方向之一,目前全球已有十余个PD-1/L1皮下制剂项目进入临床开发阶段。
国际市场方面,默沙东的帕博利珠单抗、百时美施贵宝的纳武利尤单抗均已开发皮下注射剂型,已于2024年末至2025年在海外陆续上市。辉瑞的PD-1皮下注射剂Sasanlimab针对非肌层浸润性膀胱癌的III期临床研究已公布积极结果。
国内企业同样积极布局。百济神州、君实生物、恒瑞医药等均将自家PD-1单抗开发为皮下注射剂型,恒瑞还同时开发了PD-L1阿得贝利单抗的皮下注射剂。这一趋势表明,皮下注射技术正成为免疫检查点抑制剂的标准配置。
罗氏在皮下注射剂型布局上具有先发优势。目前,罗氏与Halozyme合作,在肿瘤领域有9个皮下注射抗体药项目在开发中,其中7款已获批上市。HER2领域帕妥珠曲妥珠单抗复方皮下注射剂的成功商业化,为阿替利珠单抗皮下注射剂型的市场推广提供了宝贵经验。
5
市场前景与临床应用展望
阿替利珠单抗皮下注射剂型的上市将对中国肿瘤免疫治疗市场产生深远影响。对患者而言,治疗便利性提升将改善体验与生活质量;对医疗机构,治疗时间缩短将优化资源利用效率;对支付方,院外治疗的可行性可能降低整体医疗费用。
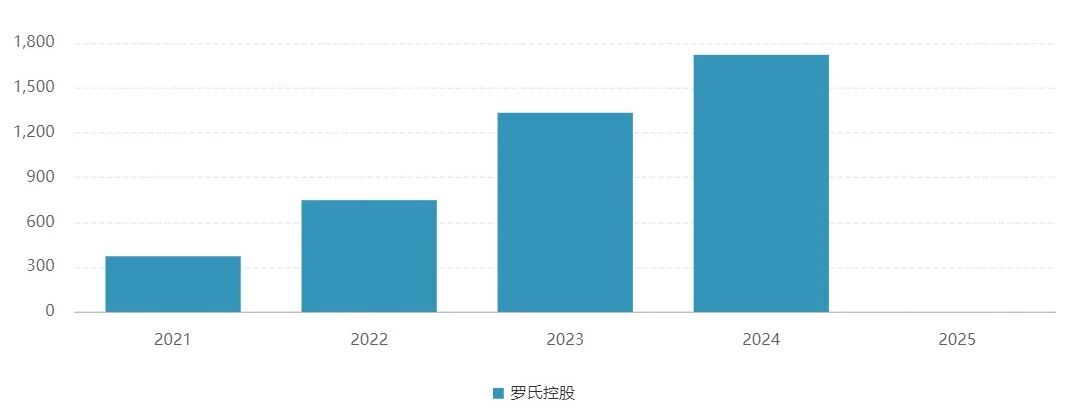
图2. 赫捷康近年来的销售数据情况,来源:药渡数据-全球药物库
商业化方面,罗氏的赫捷康®(帕妥珠曲妥珠单抗复方皮下注射剂)已展现皮下制剂的巨大市场潜力。该产品2024年实现17.4亿瑞士法郎的销售额,较2023年增长62%,证明医生和患者对该剂型的高度认可。
随着阿替利珠单抗皮下注射剂型在中国市场推广,预计将逐步替代部分静脉输注剂型的市场份额。这一转变可借鉴赫捷康®的成功经验,通过强调治疗便利性和患者偏好等优势,加速市场接受。
长远来看,皮下注射剂型为探索家庭医疗、社区医疗等新型治疗模式提供了可能。随着医疗服务不断延伸,肿瘤免疫治疗有望突破传统医院环境限制,为患者提供更灵活、便捷的选择。
结 语
罗氏阿替利珠单抗皮下注射剂型在中国的获批,是肿瘤免疫治疗领域的重要进展。这一创新剂型在保持原有疗效和安全性的基础上,显著提升了治疗便利性,改善了患者体验。
随着这一创新治疗选择进入中国市场,期待它能为中国癌症患者带来更好的治疗体验,同时推动中国肿瘤治疗水平进一步提升。在医药创新不断推进的今天,以患者需求为核心的剂型改良与技术创新同样重要。展望未来,相信会有更多以患者为中心的创新疗法问世,为癌症患者提供更加高效、便捷、人性化的治疗选择。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..