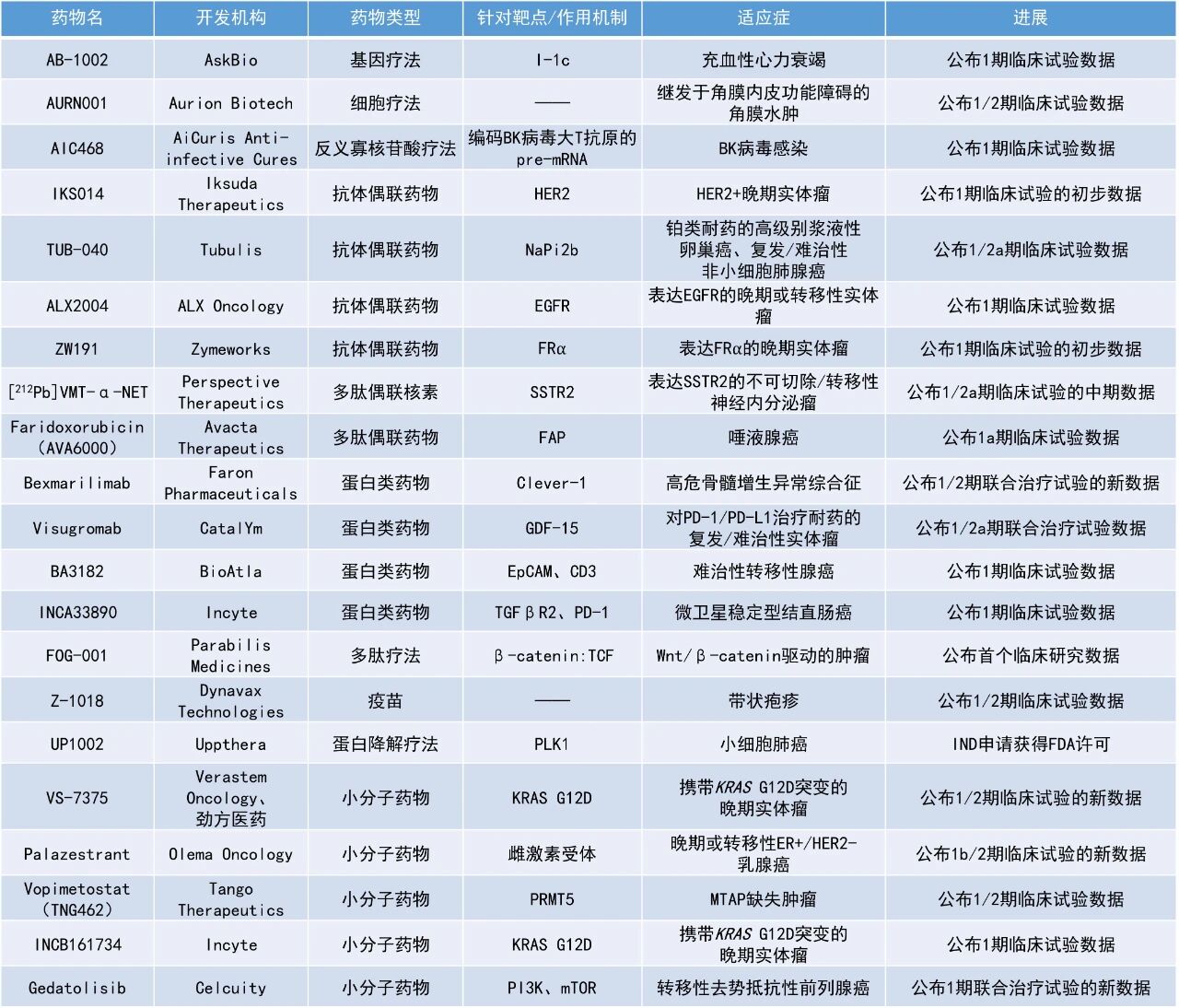
本期看点
1. 口服KRAS G12D抑制剂VS-7375用于治疗KRAS G12D突变晚期胰腺导管腺癌(PDAC),在一项1/2期临床试验中的客观缓解率(ORR)达40.7%,疾病控制率(DCR)达96.7%。
2. 靶向Clever-1的单克隆抗体bexmarilimab与阿扎胞苷联用,治疗初治高危骨髓增生异常综合征(HR-MDS)患者的早期临床试验结果亮眼,ORR达85%,完全缓解(CR)率为45%。
3. 创新靶点抗体偶联药物(ADC)TUB-040在治疗铂类耐药的高级别浆液性卵巢癌(PROC-HGSOC)患者的早期临床研究中表现亮眼,DCR达96%。
VS-7375:公布1/2期临床试验的新数据
Verastem Oncology公司公布了口服KRAS G12D抑制剂VS-7375用于治疗KRAS G12D突变晚期胰腺导管腺癌的1/2期临床试验的积极数据。VS-7375由Verastem Oncology公司与劲方医药合作开发,是一款口服、高活性、高选择性小分子抑制剂,能够同时作用于KRAS G12D蛋白的活性态(ON)和非活性态(OFF,与GDP结合)。该分子通过非共价形式结合KRAS G12D蛋白,抑制其与下游效应蛋白结合,高效抑制肿瘤细胞增殖。
该研究共纳入了66名患者,其中95.5%为IV期,且多数(68.2%)已接受过至少两线的化疗方案。截至2025年9月27日的数据,在每日600 mg的推荐2期剂量(RP2D)下,59名疗效可评估的患者中,ORR达到40.7%,DCR达96.7%,其中91.5%的患者靶病灶缩小。观察到4个月时的总生存(OS)率为92.2%,中位总生存期尚未达到,中位无进展生存期(PFS)为5.52个月。安全性方面,治疗相关不良事件导致的停药率低至3%,表明VS-7375的安全性可控。
Bexmarilimab:公布1/2期联合治疗试验的新数据
Faron Pharmaceuticals公司宣布,其靶向Clever-1的单克隆抗体bexmarilimab的一项1/2期临床试验获得了积极结果。该研究旨在评估bexmarilimab联用阿扎胞苷治疗初治高危骨髓增生异常综合征和低甲基化剂(HMA)治疗失败的复发/难治性(r/r)HR-MDS患者的安全性和有效性。Bexmarilimab是Faron公司全资拥有的在研免疫疗法,旨在通过靶向髓系细胞功能和激活免疫系统,克服对现有疗法的耐药性并优化临床疗效。Bexmarilimab能与巨噬细胞上的免疫抑制受体Clever-1结合,该受体有助于肿瘤生长和转移(即帮助癌症躲避免疫系统)。通过靶向巨噬细胞上的Clever-1受体,bexmarilimab可改变肿瘤微环境,将巨噬细胞从免疫抑制(M2)状态重编程为免疫刺激(M1)状态,上调干扰素的产生,启动免疫系统攻击肿瘤,使癌细胞对标准治疗敏感。
此次公布的结果显示,bexmarilimab联合阿扎胞苷在初治和HMA治疗失败的HR-MDS患者中的ORR分别为85%和63%。在初治HR-MDS患者中,55%实现了骨髓原始细胞的完全清除。其中,基线骨髓原始细胞<5%的患者的ORR高达100%。HMA治疗失败的r/r MDS患者的中位总生存期为13.4个月。该研究中,23%的患者在治疗后接受了造血干细胞移植(HSCT)。安全性方面,bexmarilimab联合治疗的耐受性良好,其安全性与阿扎胞苷单药治疗相似,甚至更好。
TUB-040:公布1/2a期临床试验数据
Tubulis公司公布了NAPISTAR1-01临床1/2a期研究的积极临床数据。该研究评估了公司主打抗体偶联药物TUB-040在铂类耐药的高级别浆液性卵巢癌患者中的疗效与安全性。TUB-040是一种靶向NaPi2b抗原的IgG1抗体,通过Tubulis的专有P5偶联技术连接拓扑异构酶I抑制剂exatecan,形成具有可切割连接子的ADC疗法,设计用于治疗高表达NaPi2b的卵巢癌和肺腺癌。
这次所公布的中期分析结果显示,TUB-040已完成Tubulis专有Tubutecan平台的临床概念验证(PoC),并确认NaPi2b是一个具有潜力的新型ADC靶点。分析显示,TUB-040在未经过生物标志物筛选、曾接受过多线治疗的铂类耐药卵巢癌患者中展现出显著的抗肿瘤活性和良好的耐受性。在1.67–3.3 mg/kg剂量组中,总缓解率达到59%,确认总缓解率为50%,其中在2.5 mg/kg剂量下观察到1例CR。在同一剂量区间,确认DCR为96%,在所有剂量组中总体确认DCR为91%。其中3.3 mg/kg组的疗效数据仍在持续成熟中。此外,81%的患者在治疗过程中展现CA-125应答。TUB-040在所有剂量水平下总体耐受性良好,大多数治疗伴发不良事件为1级或2级。
ZW191:公布1期临床试验的初步数据
Zymeworks公司公布了其ADC疗法ZW191治疗晚期实体瘤的1期临床试验的初步结果。ZW191靶向叶酸受体α(FRα),该靶点在约75%的高级别浆液性卵巢癌和约70%的肺腺癌中表达。ZW191具有独特的设计,可高效进入FRα阳性细胞,并释放Zymeworks开发的具旁观者效应的载荷——拓扑异构酶I抑制剂ZD06519。
截至2025年9月10日的数据,ZW191在铂类耐药卵巢癌、转移性子宫内膜癌和转移性非小细胞肺癌患者中展现出良好的初步疗效和安全性。在所有疗效可评估的患者中(n=27),ORR为44%;在妇科肿瘤患者中(n=24),ORR达50%,其中接受剂量区间为6.4 mg/kg至9.6 mg/kg的患者的ORR为64%。在≥3.2 mg/kg的剂量组中均观察到ZW191的疗效,且不限于高FRα表达的肿瘤。安全性方面,ZW191表现出可控的安全性,剂量调整/延迟率低。
INCB161734:公布1期临床试验数据
Incyte公司公布了其候选药物INCB161734用于治疗携带KRAS G12D突变的晚期或转移性实体瘤的1期临床试验的积极数据。INCB161734是一款高选择性靶向KRAS G12D突变的口服小分子药物,其可以皮摩尔级亲和力同时结合KRAS G12D的ON和OFF两种状态,相较于野生型KRAS展现出超过80倍的选择性。临床前研究显示,该药物具备优异的口服生物利用度。口服给药后,INCB161734能够实现持续的高水平靶点占有率,在KRAS G12D突变胰腺癌小鼠模型中几乎可维持整个给药间隔的接近最大程度的抑制效果。
截至2025年8月1日的数据,在所有接受治疗的患者中都表现出可控的安全性。在每日接受600 mg(n=25)和1200 mg(n=29)剂量INCB161734的胰腺导管腺癌患者中,ORR分别达20%和34%,DCR分别高达64%和86%。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..