引言:
2025年10月9日,国家药监局、卫健委、中医药局三大部门联合发布《关于进一步推进中药注射剂上市后研究和评价的公告》,明确提出“主动评价一批、责令评价一批、依法淘汰一批”的核心举措。这意味着,所有在2019年《药品管理法》实施前已上市的中药注射剂,若不能按要求完成上市后研究和评价工作,将会被市场淘汰。
2025年10月17日,CDE发布《中药注射剂上市后研究和评价基本技术要求(征求意见稿)》和《中药注射剂上市后研究和评价申报资料要求(征求意见稿)》,这两份文件犹如及时雨,为持有人完成中药注射剂上市后研究和评价工作、撰写申报资料提供针对性指导。
1.上市后研究和评价基本技术要求
中药注射剂上市后研究的主要内容包括预期临床安全性和有效性评估、药学研究、非临床安全性研究、临床有效性和安全性研究、作用机理研究、其他研究共六个部分。核心要点见下表:
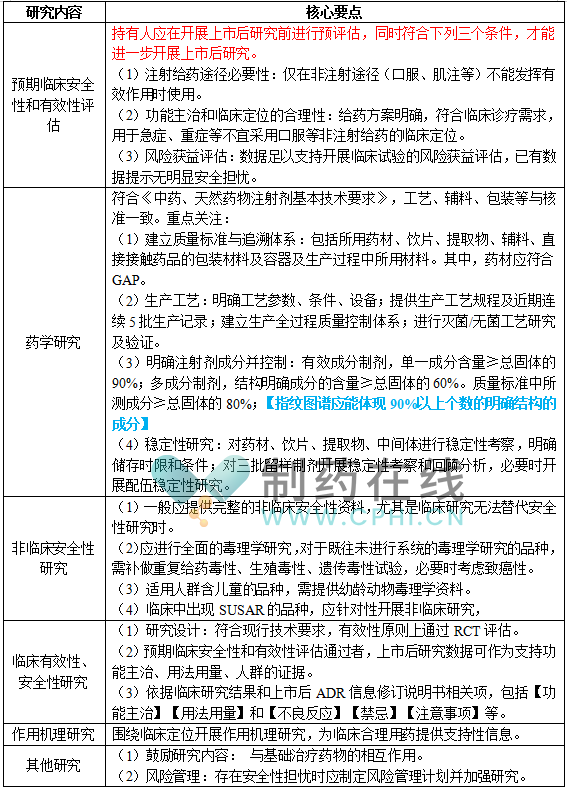
2.申报资料要求
申报资料整体格式参照《已上市中药变更事项及申报资料要求》,具体内容参照《中药注册分类及申报资料要求》,基于品种情况,可酌情简化或免于提供部分相关资料(如制备工艺路线筛选、剂型选择、辅料及直接接触药品的包装材料研究等)。申报资料的主要内容要求参见下表:
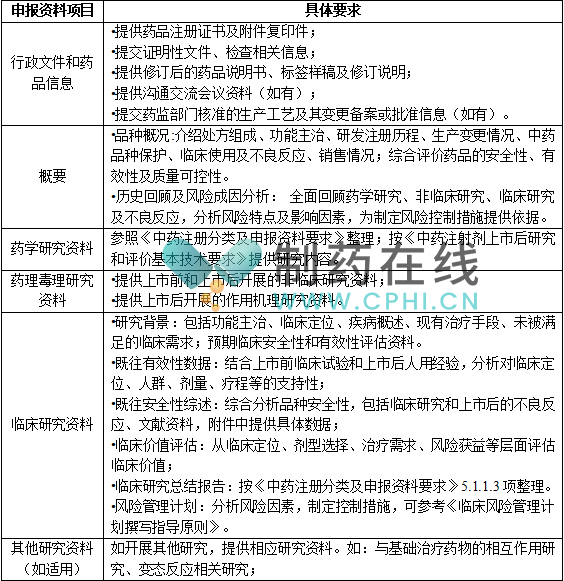
3.申报资料递交途径
持有人完成中药注射剂上市后研究和评价后,登录药品业务应用系统,填写注册申请表,按照“国家药品监管部门审批的补充申请其他事项”申报类别,选择“基于中药注射剂上市后研究和评价需要”栏目,向CDE提交上市后研究和评价资料。
参考文献:
【1】《关于进一步推进中药注射剂上市后研究和评价的公告》
【2】《中药注射剂上市后研究和评价基本技术要求(征求意见稿)》
【3】《中药注射剂上市后研究和评价申报资料要求(征求意见稿)》
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..