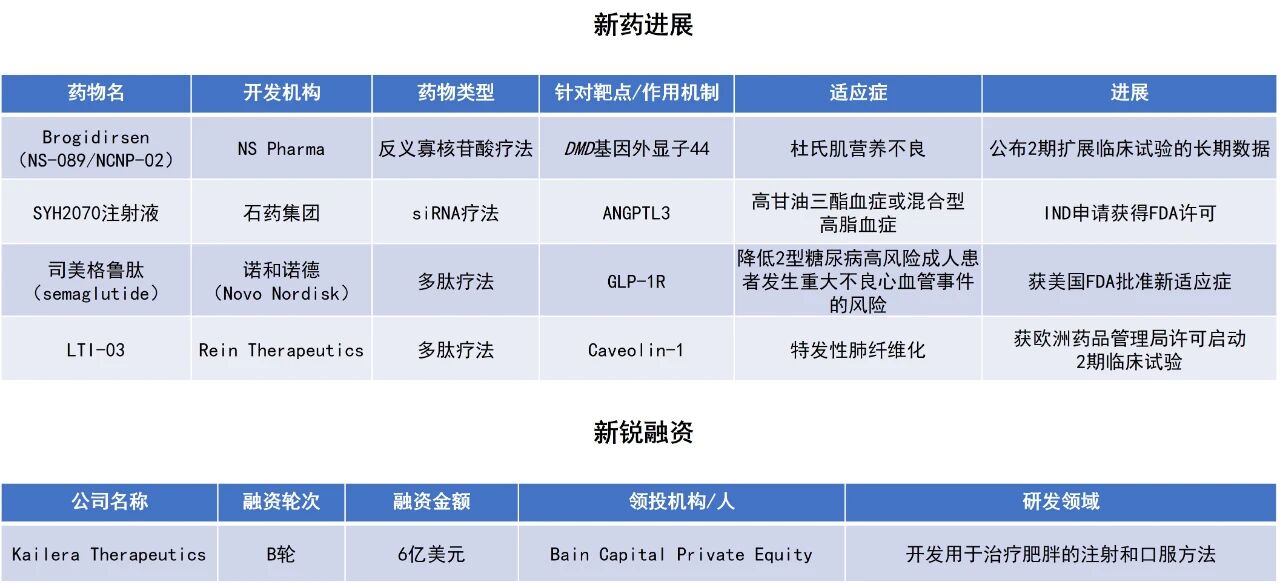
近期,全球多肽和寡核苷酸(TIDES)领域迎来系列进展。美国FDA批准Rybelsus(口服司美格鲁肽)的新适应症,用于降低2型糖尿病高风险成人患者发生重大不良心血管事件(MACE,即心血管死亡、心脏病发作或中风)的风险,无论其是否有既往心血管事件。用于治疗杜氏肌营养不良(DMD)的反义寡核苷酸(ASO)疗法brogidirsen的长期研究结果积极。石药集团小干扰RNA(siRNA)降脂新药SYH2070注射液在美国获批临床。Kailera Therapeutics公司宣布完成6亿美元B轮融资,主要用于推进注射型胰高血糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素多肽(GIP)受体双重激动剂KAI-9531进入3期临床试验。本文将节选其中部分重要进展做简单介绍,仅供读者参阅。
司美格鲁肽:获美国FDA批准新适应症
诺和诺德(Novo Nordisk)宣布,美国FDA已批准Rybelsus的新适应症,用于降低2型糖尿病高风险成人患者发生MACE的风险,无论其是否有既往心血管事件。根据新闻稿,此次获批使Rybelsus成为首款可降低2型糖尿病高风险成人患者MACE风险的口服GLP-1药物。
此次批准主要基于3b期SOUL研究的结果。分析显示,司美格鲁肽组4825名受试者中有579例(12.0%)发生MACE,而安慰剂组4825名受试者中有668例(13.8%,HR=0.86;95% CI:0.77–0.96;p=0.006)。口服司美格鲁肽在4年内使MACE风险相对降低14%(3年时绝对风险降低2%),与安慰剂相比差异具有统计学显著性。SOUL研究中口服司美格鲁肽的总体安全性与既往研究结果一致。
Brogidirsen(NS-089/NCNP-02):公布2期扩展临床试验的长期数据
Nippon Shinyaku的子公司NS Pharma宣布,其用于治疗DMD的在研疗法brogidirsen,取得了积极的2期临床试验扩展研究的3.5年疗效与安全性数据。Brogidirsen是一种ASO疗法,由Nippon Shinyaku与日本国立神经与精神卫生研究中心(NCNP)共同发现,旨在针对适合进行外显子44跳跃的DMD患者。本次公布的数据来自NCNP发起的临床试验及其后续由Nippon Shinyaku开展的扩展研究,共纳入6名接受每周静脉注射brogidirsen的患者。
研究结果显示,brogidirsen在长期治疗中表现出持续的治疗潜力:在第25/26周和第99/100周的肌肉活检中均观察到高效的外显子44跳跃和抗肌萎缩蛋白(dystrophin)表达;能够行走的患者在长期用药后,其运动功能得以维持;在长达3.5年的治疗期间,未报告任何与药物相关的严重或重度不良事件、过敏反应,亦无患者因此停药,整体安全性良好。这些结果表明brogidirsen有望改变DMD的疾病进程,目前该长期扩展研究仍在继续,以进一步评估其长期疗效与安全性。
SYH2070注射液:IND申请获得FDA许可
石药集团宣布,该公司自主研发的双链siRNA药物SYH2070注射液已获得美国FDA批准,可在美国开展临床试验。该产品亦于今年9月在中国获批临床。根据石药集团新闻稿介绍,SYH2070注射液是一款通过偶联乙酰半乳糖胺(GalNAc)实现肝脏靶向递送的siRNA药物,以皮下给药的方式靶向血管生成素样蛋白3(ANGPTL3)的mRNA,能有效降低ANGPTL3水平。通过优化序列和化学修饰的策略,该产品实现更持久的基因沉默效果,有望成为超长效降低ANGPTL3的siRNA药物,适用于治疗高甘油三酯血症或混合型高脂血症,具备有效降低残余胆固醇水平升高风险的潜力。
临床前研究显示,该产品在药物活性和药效持续性方面均优于同类型siRNA产品,展现出药物作用效果持久、安全性良好、患者依从性高等差异化优势,具有较高的临床开发价值。
Kailera Therapeutics公司完成6亿美元B轮融资,强化肥胖管线
Kailera Therapeutics公司宣布完成6亿美元B轮融资。本轮融资由Bain Capital Private Equity领投,所获资金将用于推进其差异化的肥胖症治疗产品管线的开发。融资款项将主要用于支持其核心候选药物KAI-9531(一款注射用GLP-1/GIP双受体激动剂,具有潜在“best-in-category”的减重效果)在年底前启动全球3期临床试验。同时,资金也将用于推进其口服小分子GLP-1受体激动剂KAI-7535开展全球临床研究。该药在中国的2期临床试验中已表现出具有竞争力的减肥效果。该公司也将继续推进其早期项目,包括注射用GLP-1/GIP/胰高血糖素受体三激动剂KAI-4729,以及每日一次口服型KAI-9531。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..