FDA的CDER在5月份发表文章《牢记最终目标:回顾美国FDA对包含真实世界数据的申报的检查》,基于案例分析阐述GCP检查在涉及真实世界数据(RWD)时遇到的问题和挑战,并系统性提出了RWD的GCP检查要点。
RWD检查案例
RWD通常未按GCP标准收集。在临床实践中,数据收集方法难以控制,容易导致数据缺失、不准确和偏倚。此外,不同系统间的数据收集、记录和维护方式不一致,且缺乏质量控制监测,使得数据质量、完整性和可靠性的评估变得复杂。FDA基于数据对支持监管决策的目的和贡献来决定是否在GCP检查中包含RWD评估的检查。
文章通过FDA检查案例介绍了访问RWD源记录、评估数据质量、评价数据管理、转换和分析流程的挑战。
在一项依赖外部对照试验数据支持新药批准的申请中,FDA因隐私法规和第三方协议限制,无法获取RWD源记录。最终,申办方与第三方达成协议,满足当地伦理委员会要求,使FDA能够访问这些记录,验证数据的可靠性。
一项以临床医生报告结果为主要疗效终点的外部对照试验中,FDA检查发现,对照组数据在临床实践中收集和评估方法与试验组存在显著不一致,导致关键研究数据不可靠。另一项外部对照试验中,申办方从疾病特定注册数据库中提取数据,但因缺乏数据转录过程的审计跟踪和质量控制,导致源记录与提交给FDA的数据之间存在显著差异。
此外在一项检查中,FDA发现申办方未能提供支持外部对照组人群识别的医疗记录等文件,导致难以评估选择偏倚。
总结实际检查中的突出挑战
尽管FDA已发布了关于使用RWD的指导文件,但其实际检查经验表明,在一些方面仍面临诸多挑战:
向FDA提供RWD源记录(或经认证的副本)访问权限的可行性;
向FDA提交申请之前解决与知情同意和记录匿名化相关的问题;
评估研究中使用的RWD来源和数据库,及RWD的质量;
实施确保RWD质量的方法(例如,在从来源提取RWD后进行申办者监测);
维护和保留用于评估与RWD管理、转换和分析相关流程和程序的文档。
文章强调,使用RWD支持监管决策有赖于FDA在检查中验证数据质量和可靠性,并建议申办方尽早与FDA沟通。
使用RWD生成真实世界证据(RWE)的研究检查重点
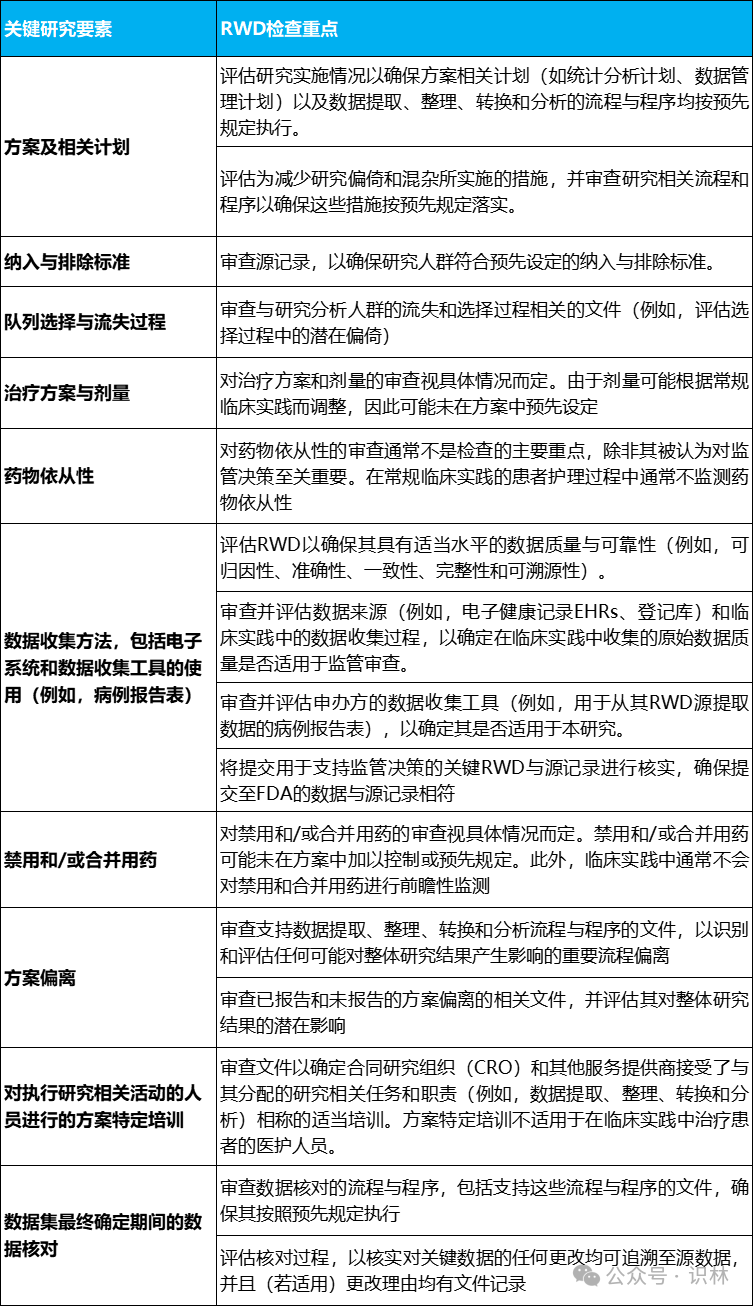
文献提供了一个表格,罗列了FDA针对临床研究每个领域的真实世界相关检查重点。翻译供参考。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..