据 Insight 数据库统计,8 月份(8.1-8.27),有 9 款国产新药首次进入 III 期临床阶段,开始向上市申请发起冲刺。
从药物类型来看,包括 6 款化药和 3 款生物药。本文从中选择部分项目跟大家分享。
8 月首次进入 III 期的国产新药
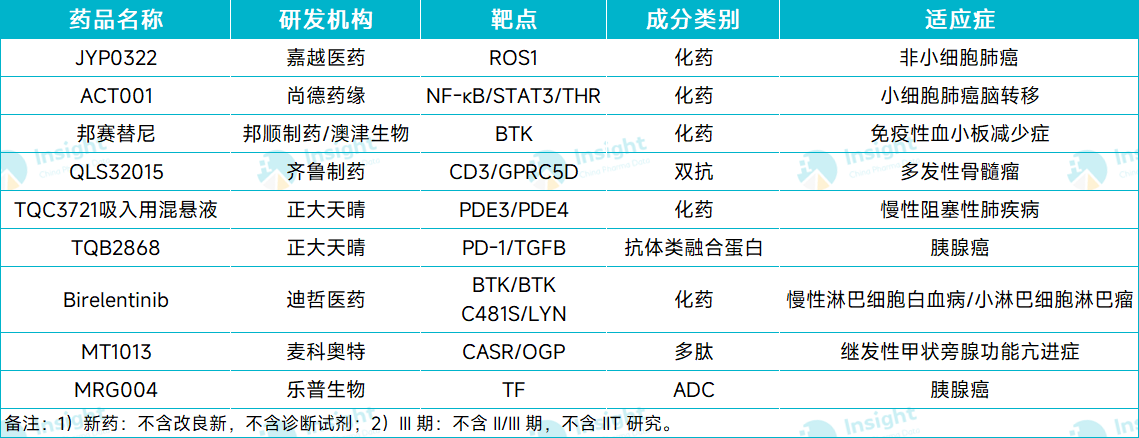
图片来源:Insight 数据库整理(数据统计时间:8.1-8.27)
乐普生物 MRG004A
TF ADC
8 月 1 日,乐普生物在国内启动一项随机对照、双盲、多中心 III 期临床研究,旨在对比 MRG004A 联合最佳支持治疗与安慰剂联合最佳支持治疗在局部晚期或转移性胰腺癌的总生存期。
MRG004A 是一款极具创新性的靶向组织因子(TF)的 ADC 药物,通过 Glyco Connect™ 定点偶联及 Hydra Space™ 极性间隔技术连接 TF 靶向单抗与高效抗微管剂 MMAE,也是国内首款进入临床的 TF ADC 药物,其具有可管理的安全性和显著的抗肿瘤活性,特别是在复发或转移性胰腺癌患者中。
在 2024 年 ASCO 大会上,乐普生物公布了 MRG004A 中美联合开展的首次人体、剂量递增与扩展研究的期中成果。截至 2023 年 12 月 15 日,MRG004A 的剂量已递增至 2.6mg/kg,MTD 尚未达到。
在接受 2.0mg/kg 剂量治疗的 12 例可评估的胰腺癌患者中,MRG004A 显示出令人鼓舞的抗肿瘤活性。这些患者的既往中位治疗线数为 3 线,其中 4 例达到部分缓解(PR),6 例疾病稳定(SD),ORR 为 33.3%(4/12),DCR 高达 83.3%(10/12)。
值得一提的是,5 例 TF 表达 ≥50%、染色强度为 3+ 且既往治疗线数不超过二线的胰腺癌患者,在接受 2mg/kg 的 MRG004A 治疗后,其中 4 例达到 PR,1 例达到 SD。
2025 年 8 月,MRG004A 已被 CDE 正式纳入突破性治疗药物品种,针对适应症为既往经至少二线系统性治疗失败的晚期胰腺癌。
正大天晴 吸入用 TQC3721 混悬液
PDE3/4 抑制剂
8 月 18 日,正大天晴在国内启动一项多中心、随机、双盲、安慰剂对照 III 期临床试验,旨在评价吸入用 TQC3721 混悬液在中重度慢性阻塞性肺疾病患者中有效性和安全性。
TQC3721 是一款全新机制的吸入性 PDE3/4 抑制剂,具有扩张支气管和抗炎的双重作用,从而减轻患者症状,并抑制炎症,控制疾病进展。
临床研究结果显示,TQC3721 在单支扩剂和双支扩剂背景治疗的 COPD 患者中,肺功能和症状评分有显著改善,相关数据将在近期国际学术会议上公布。
此外,除吸入用混悬液外,TQC3721 吸入粉雾剂正处在临床 I 期开发阶段,干粉剂型有望进一步提升患者的依从性。
Insight 数据库显示,国内共有 5 款 PDE3/4 抑制剂进入临床阶段,分别来自海思科(HSK39004)、正大天晴(TQC3721 吸入用混悬液、吸入粉雾剂)、恒瑞/GSK(HRS-9821)、默沙东/优锐医药(恩塞芬汀)。
尚德药缘 ACT001
多靶点小分子免疫调节剂
8 月 25 日,尚德药缘在国内启动了一项随机、盲法、安慰剂对照的 III 期临床研究,旨在评估 ACT001 增强小细胞肺癌脑转移放疗疗效和减轻全脑放疗毒副反应的作用。
ACT001 是由尚德药缘全球独家开发的多靶点小分子免疫调节剂,在全球免疫调节剂中的独特优势是:能够很好地穿过血脑屏障,并且能够可逆地开放血脑屏障,帮助其它药物提高入脑浓度。因此 ACT001 主要用于颅内疾病的治疗,从而有效地避开全球竞争药物。
2022 年 ASCO 上,尚德药缘曾公布了 ACT001 和全脑放疗 (WBRT) 治疗实体瘤和脑转移患者疗效和安全性的 I/II 期临床研究结果。
截至 2021 年 12 月 31 日,队列 C(安慰剂组)、A (ACT001 200 mg,每日两次)和 B(ACT001 400mg,每日两次) 中分别有 7、13 和 10 名患者接受了治疗后 MRI 扫描。
根据 iRANO 标准,队列 C 中有 3 名患者(3/7,42.9%)、队列 A 中有 11 名患者(11/13,84.6%)和队列 B 中有 9 名患者(9/10,90.0%)出现颅内病变部分缓解。
正大天晴 TQB2868
PD1/TGF-β 双功能融合蛋白
8 月 12 日,正大天晴在国内启动了一项随机、双盲、平行对照、多中心 III 期临床试验,旨在评价 TQB2868 注射液与盐酸安罗替尼胶囊联合化疗对比安慰剂联合化疗一线治疗转移性胰腺导管腺癌(mPDAC)的疗效和安全性。
TQB2868 是正大天晴自主研发的 PD1/TGF-β 双功能融合蛋白,于 21 年 9 月首次申请临床,同年 11 月获批临床,次年 1 月首次公示临床。
在 2025 年 ASCO 大会上,正大天晴公布了一项 TQB2868 联合安罗替尼和化疗(AG 方案)一线治疗 mPDAC 的 II 期临床研究结果。
截至 2025 年 1 月,该研究已入组 40 例,均为 IV 期转移性胰腺癌患者,其中 36 例可评估,初步数据显示:
客观缓解率(ORR)达 63.9%,为 AG 化疗方案历史数据(23%-36%)的 2-3 倍;
疾病控制率(DCR)达 100%,是 AG 化疗方案(62.3%)的 1.6 倍;
中位无进展生存期(mPFS)尚未达到,6 个月 PFS 率达 86%,是 AG 化疗方案(43.2%)的 2 倍;
中位生存期(mOS)尚未达到,预期有望超过 1 年;
安全耐受性良好,3 级及以上不良反应发生率为 52.5%(AG 化疗方案为68.1%-77%)。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..