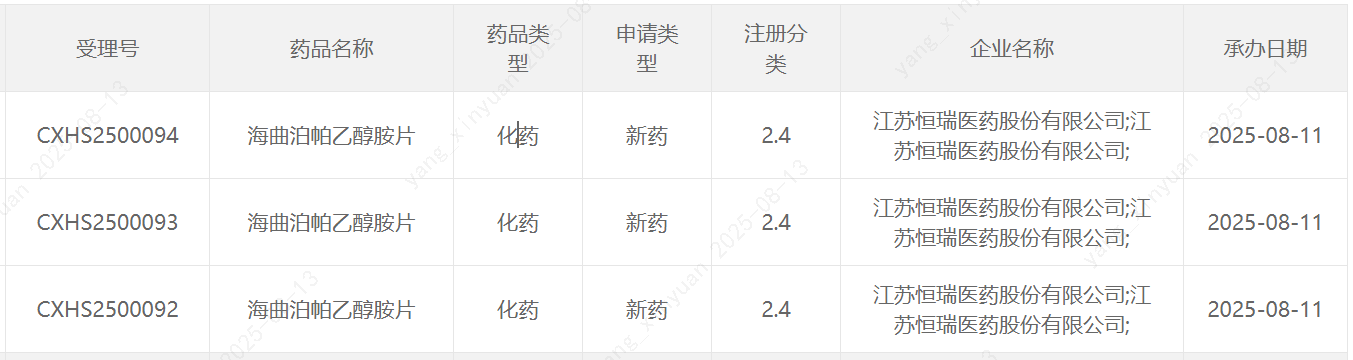
8月12日,恒瑞医药宣布其自主研发的1类新药海曲泊帕乙醇胺片的药品上市许可申请获中国国家药监局(NMPA)受理,适应症为:适用于既往对糖皮质激素、免疫球蛋白等治疗反应不佳的原发免疫性血小板减少症(ITP)成人及≥6岁的儿童患者。
原发免疫性血小板减少症(ITP)是一种获得性自身免疫性出血性疾病,临床表现以皮肤黏膜出血为主,严重者有内脏出血,甚至颅内出血而导致死亡,是儿童和青少年常见的出血性疾病。儿童ITP(1月龄至18岁的原发性ITP患儿)根据病程分为:新诊断(病程<3个月)、持续性(3~12个月)和慢性(>12个月)。儿童ITP是一个良性自限性疾病,80%的病例在诊断后12个月内血小板计数可恢复正常,但仍有约20%的患儿病程持续1年以上。儿童ITP患者基数较大,临床治疗需求迫切。多项指南推荐,血小板生成素受体激动剂为二线治疗首选药物。
海曲泊帕乙醇胺片是一种口服非肽类血小板生成素受体激动剂,通过激活血小板生成素受体介导的STAT和MAPK信号转导通路,促进血小板生成。该产品已在原发免疫性血小板减少症、再生障碍性贫血、化疗所致血小板减少症、有创性操作或手术的慢性肝病伴血小板减少症患者中开展临床研究,以评估在不同血液系统疾病中的作用。海曲泊帕乙醇胺片已获批上市两个适应症,分别为:2021年6月获得NMPA批准用于既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症成人患者的治疗,以及用于对免疫抑制治疗疗效不佳的重型再生障碍性贫血成人患者的治疗。此外,该产品用于恶性肿瘤化疗所致血小板减少症适应症(CIT)已获美国FDA授予孤儿药资格。
此次申报上市,是基于一项在儿童和青少年原发免疫性血小板减少症患者中评价海曲泊帕乙醇胺片的有效性和安全性的多中心、随机、双盲及开放性的3期临床试验(HR-TPO-ITP-Ⅲ-PED)。2025年3月,该研究达到了方案预设的主要研究终点。该研究共入组100例6岁及以上儿童和青少年原发免疫性血小板减少症患者。研究结果表明,试验组在主要终点上显著优于对照组,证实了海曲泊帕乙醇胺片长期治疗的安全性、有效性良好。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..