本期看点
2. 多靶点抑制剂gedatolisib联合雄激素受体抑制剂治疗转移性去势抵抗性前列腺癌(mCRPC)的早期临床结果积极,6个月的放射学无进展生存率(rPFS)达66%。
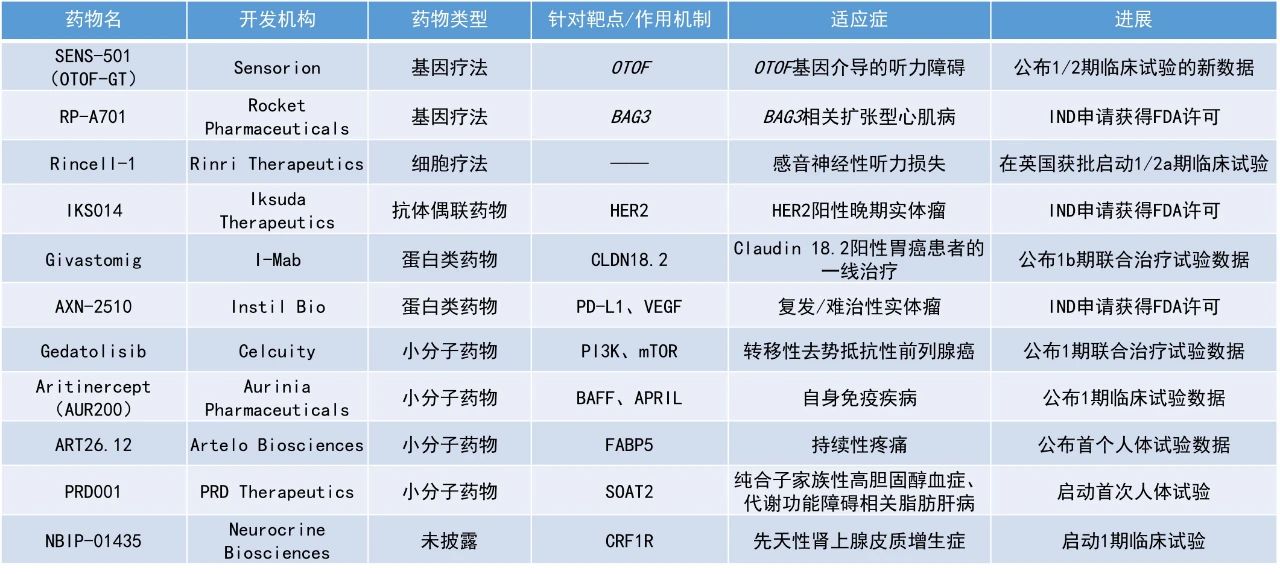
Givastomig:公布1b期联合治疗试验数据
天境生物公布了其双特异性抗体givastomig的1b期联合治疗试验的积极数据。Givastomig是一种靶向Claudin 18.2(CLDN18.2)阳性肿瘤细胞的双特异性抗体,在表达Claudin 18.2的肿瘤微环境中通过4-1BB信号通路有条件地激活T细胞。该药由天境生物牵头与ABL Bio公司共同开发,两方平等共享除大中华区和韩国以外的全球权益。目前,givastomig正被开发用于一线治疗转移性胃癌,并具有在其他实体瘤中进一步拓展的潜力。
截至2025年5月15日的数据,17例Claudin 18.2阳性晚期转移性胃癌患者接受了不同剂量的givastomig联合nivolumab和mFOLFOX6作为一线治疗。数据显示,在所有剂量组中确认的ORR为71%(12/17),DCR达100%。在选定用于剂量扩展的两个剂量组(8 mg/kg和12 mg/kg)中,ORR为83%(10/12)。值得注意的是,即使在PD-L1或CLDN18.2表达水平较低的患者中也观察到了缓解。17名患者中有8名仍在接受治疗,截至数据截止日期,最长的治疗持续时间为13.3个月。安全性方面,联合疗法的耐受性良好,未出现3级或以上的恶心呕吐事件,仅有一例3级治疗相关不良事件(肝酶升高)。
Gedatolisib:公布1期联合治疗试验数据
Celcuity公司公布了其在研药物gedatolisib在一项针对转移性去势抵抗性前列腺癌患者的1期临床试验中的初步积极数据。Gedatolisib是一种强效的多靶点抑制剂,可同时靶向所有四种I类PI3K亚型以及mTOR复合物mTORC1和mTORC2,从而全面阻断关键的PI3K/AKT/mTOR(PAM)信号通路。
该试验评估了gedatolisib联合雄激素受体抑制剂darolutamide在mCRPC患者中的安全性和初步疗效。截至2025年5月30日的数据,6个月的rPFS为66%。安全性方面,没有患者因治疗相关不良事件停止治疗,也未发生剂量调整,没有3级高血糖事件,仅10.5%的患者出现2-3级口腔炎,均为可控范围。在另一项gedatolisib联合曲妥珠单抗作为3线疗法治疗HER2阳性转移性乳腺癌患者的2期临床试验中,ORR为43%。
ART26.12:公布首个人体试验数据
Artelo Biosciences公司公布了其在研药物ART26.12的首个人体临床试验的积极结果。ART26.12是一种新型脂肪酸结合蛋白5(FABP5)抑制剂。作为一种外周作用的非阿片类、非甾体类镇痛剂,其初步临床开发目标是用于治疗化疗引起的周围神经病变(CIPN)。新闻稿指出,ART26.12是首个在人体中进行评估的口服活性FABP5抑制剂。此次公布的数据显示,ART26.12在健康受试者中表现出良好的安全性和可预测的药代动力学特性,与其此前在临床前研究中观察到的表现一致。
Aritinercept(AUR200):公布1期临床试验数据
Aurinia Pharmaceuticals公司公布了其用于治疗自身免疫疾病的B细胞活化因子(BAFF)和增殖诱导配体(APRIL)双重抑制剂aritinercept的1期单剂量递增(SAD)研究的积极结果。Aritinercept在所有测试的剂量水平下都具有良好的耐受性。单剂量aritinercept可使受试者的免疫球蛋白稳定且持久地减少,从基线到接受治疗后第28天,免疫球蛋白A(IgA)、免疫球蛋白M(IgM)和免疫球蛋白G(IgG)的平均降幅分别为48%、55%和20%。药效学效应支持每月一次的给药方案。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..