本期看点
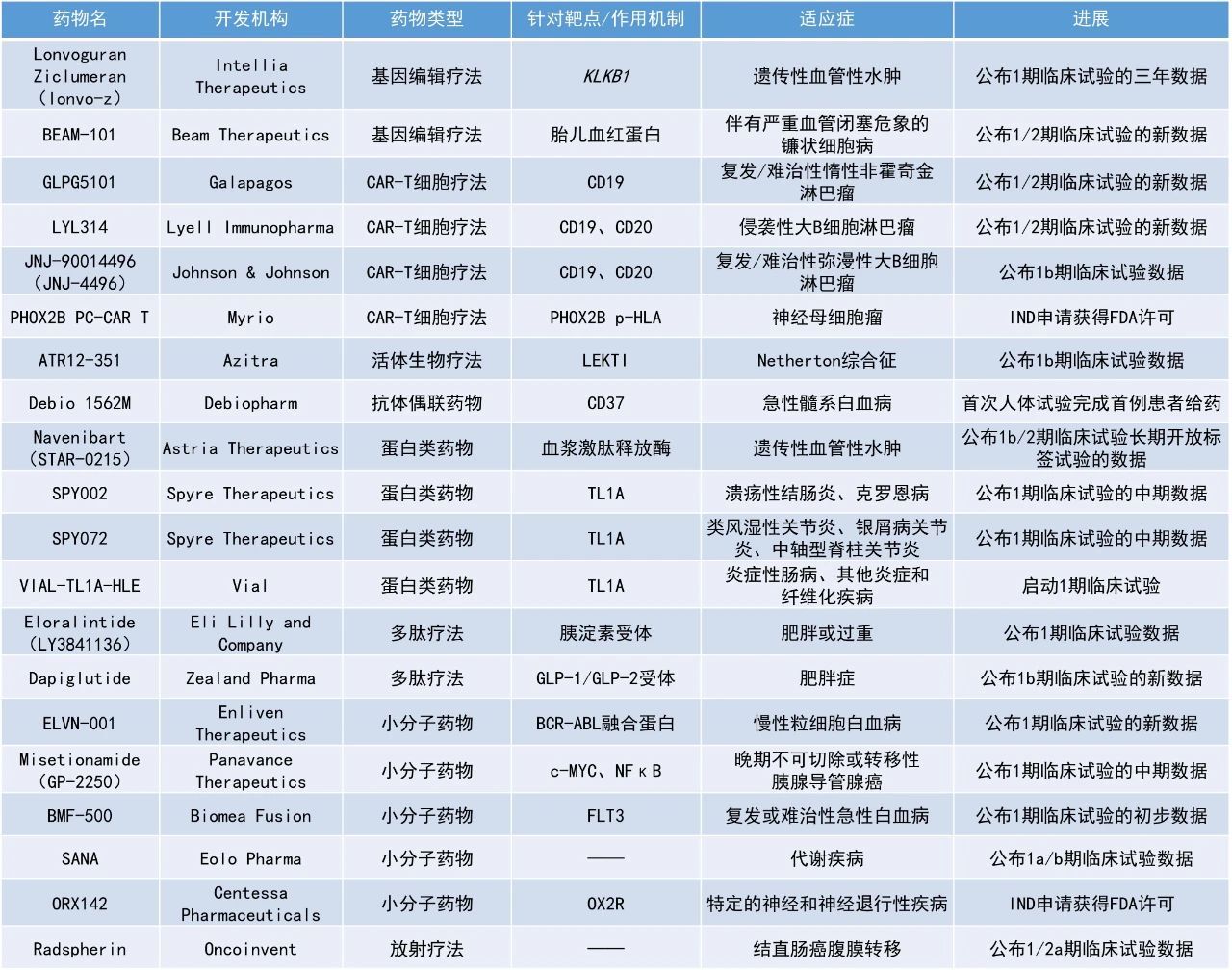
INCA033989:公布首个临床研究数据
Incyte近日公布其创新疗法INCA033989的首个临床研究数据,该药物为一款潜在“first-in-class”、mutCALR靶向单克隆抗体,用于治疗携带此突变的骨髓增殖性肿瘤患者。数据显示,在接受INCA033989治疗的高危原发性血小板增多症(ET)的患者中,各剂量组均实现了快速且持久的血小板计数正常化,高剂量组(>400 mg)患者应答更为显著。其中,86%的患者达到完全或部分血液学缓解,82%达CR;89%(34/38)的可评估患者mutCALR等位基因频率(VAF)降低,且21%(8/38)患者在仅接受3个治疗周期后即实现超过50%的VAF下降。
单细胞DNA测序探索性研究进一步显示,INCA033989能够选择性靶向并减少携带mutCALR的造血干祖细胞(CD34阳性)及髓红系细胞,同时促进正常(野生型CALR)细胞的恢复,支持健康造血功能的重建。骨髓活检结果亦验证了这一机制,mutCALR阳性巨核细胞减少、阴性巨核细胞增加。安全性方面,INCA033989在24至2500 mg的全部剂量范围内耐受性良好,无剂量限制性毒性(DLT),仅1例患者因治疗伴发不良事件(TEAEs)停药,另有1例发生剂量调整。最常见的TEAEs为疲劳(26.5%)和上呼吸道感染(20.4%),均为1-2级。
Navenibart(STAR-0215):公布1b/2期临床试验长期开放标签试验的数据
Astria Therapeutics公司公布了其血浆激肽释放酶单抗抑制剂navenibart治疗遗传性血管性水肿的1b/2期临床试验长期开放标签试验的数据。此次公布的结果显示,患者每月的发作率大幅降低,平均降幅达92%,降幅中位数达97%。频率为每3个月给药一次组别患者的平均每月发作率降低了95%,而每6个月给药一次组别患者的平均降幅为86%。安全性方面,navenibart总体耐受性良好,无严重的治疗伴发不良事件,无停药现象。
ELVN-001:公布1期临床试验的新数据
Enliven Therapeutics公司公布其小分子激酶抑制剂ELVN-001治疗慢性粒细胞白血病(CML)患者的1期临床试验的新数据。ELVN-001是一种强效、高选择性、潜在“best-in-class”的小分子激酶抑制剂,专门针对CML患者的致癌驱动因子BCR-ABL融合蛋白。ELVN-001还具有针对耐药性最强的BCR-ABL1耐药突变体T315I和其他已知耐药突变体的活性。
截至2025年4月28日的数据,在53例可评估的患者中,47%(25/53)在24周时达到主要分子学缓解(MMR),其中最后一线治疗时对酪氨酸激酶抑制剂(TKI)耐药的患者中有41%(14/34)在24周时处于MMR,曾接受asciminib或ponatinib治疗的患者中也有35%(12/34)在24周时处于MMR。所有达到或维持MMR的患者在数据截止时仍保持缓解。在该临床试验中所纳入的患者群体此前接受过大量治疗的情况下,ELVN-001与已获批的针对BCR-ABL融合蛋白的TKI在1期试验中所观察到的MMR相比,结果依然更好。安全性方面,ELVN-001在所有剂量水平上继续表现出良好的安全性和耐受性。
BMF-500:公布1期临床试验的初步数据
Biomea Fusion公司公布了其共价FLT3抑制剂BMF-500治疗复发/难治性急性白血病的初步临床数据。BMF-500是一种新型、口服可利用的、高效、具选择性的FLT3共价小分子抑制剂。此前的研究表明,BMF-500潜在的脱靶风险较小,对活化的FLT3突变(包括FLT3-ITD和各种酪氨酸激酶结构域突变)具有皮摩尔级的亲和力。在携带FLT3-ITD突变的急性髓系白血病(AML)小鼠模型中,BMF-500使小鼠的肿瘤完全消退,且不需要持续暴露即可维持疗效。
BMF-500在治疗FLT3突变的复发/难治性急性白血病患者中表现出令人鼓舞的初步疗效。在可评估的11例FLT3突变患者中,9人出现骨髓原始细胞下降,5人降幅超过50%。同时,在FLT3野生型患者中也观察到疾病控制效果。所有接受治疗的FLT3突变患者(n=18)的中位总生存期(mOS)为3.8个月(无CYP3A4抑制剂)和3.5个月(有CYP3A4抑制剂)。该数据优于历史对照数据,接受过gilteritinib和venetoclax治疗失败后的复发/难治性FLT3突变AML患者的历史mOS仅为2.1个月。BMF-500在各个剂量水平上总体耐受良好,未报告剂量限制性毒性、QT间期延长或因治疗相关不良事件导致的停药。
Misetionamide(GP-2250):公布1期临床试验的中期数据
Panavance Therapeutics公司公布了其小分子疗法misetionamide(GP-2250)联用吉西他滨治疗晚期不可切除或转移性胰腺导管腺癌患者1期临床试验的中期数据。Misetionamide具有独特的作用机制,可抑制两种致癌转录因子c-MYC和NFκB。此次公布的结果显示,与单独使用吉西他滨的历史结果相比,接受misetionamide联用吉西他滨治疗患者的确认的缓解率、疾病稳定率和无进展生存期更优,约42%的患者达到部分缓解或疾病稳定。此外,misetionamide联用吉西他滨的安全性良好,与单独使用吉西他滨的预期毒性相比,没有明显的新毒性或加剧的毒性。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..