根据 Insight 数据库,截至 5 月 28 日,共计有 21 款新药在五月向 NMPA 递交了上市申请(含新适应症),包括 7 个首次上市申请和 14 个新适应症申请。
从注册分类来看,21 款药中,国产药有 13 款,进口药有 8 款。药物类型上,化药有 10 款,生物药有 11 款。本文将节选其中几款潜在重磅抗肿瘤新药信息做介绍,仅供参阅。
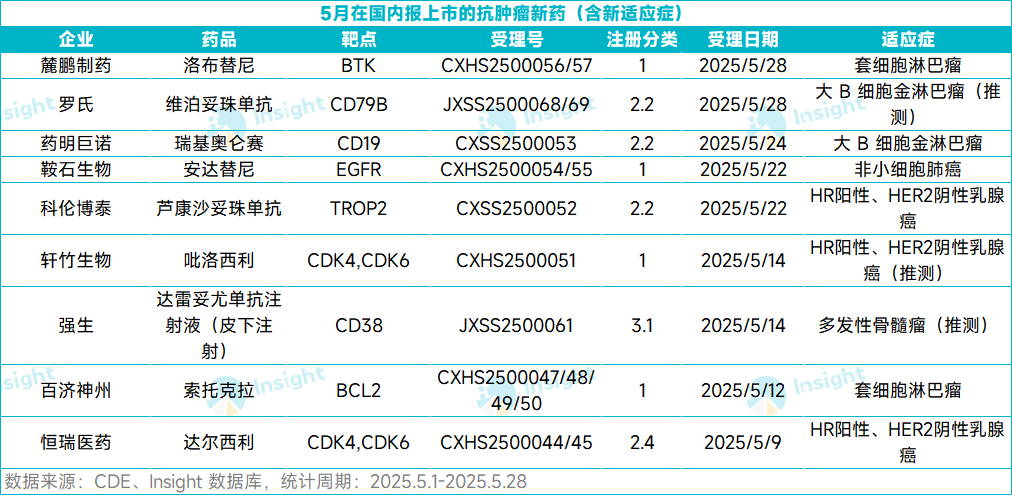
恒瑞医药「达尔西利」
申报第 3 项适应症
5 月 9 日,恒瑞医药达尔西利的第 3 项适应症上市申请获得 CDE 受理,适应症为:达尔西利联合内分泌治疗用于 HR 阳性、HER2 阴性的早期或局部晚期乳腺癌的辅助治疗。
达尔西利是恒瑞自主研发的口服、选择性的小分子 CDK4/6 抑制剂,此前已在国内获批两项适应症:1)与氟维司群联合用于既往曾接受内分泌治疗后出现疾病进展的 HR 阳性、HER2 阴性复发或转移性乳腺癌患者;2)与芳香化酶抑制剂联合使用作为初始内分泌治疗用于 HR 阳性、HER2 阴性局部晚期或转移性乳腺癌患者。
本次申报的新适应症是基于一项多中心、随机、双盲的 III 期临床试验 DAWNA-A 的结果。该研究旨在评估达尔西利联合内分泌治疗在 HR 阳性、HER2 阴性女性乳腺癌辅助治疗中的效果,共入组超 5000 例受试者。研究的主要终点为患者无侵袭性疾病生存期(IDFS)。
2025 年 2 月,DAWNA-A 研究已达到主要研究终点。研究结果显示,与安慰剂联合内分泌治疗相比,达尔西利联合内分泌治疗可显著降低患者复发风险,提高患者无侵袭性疾病生存期。
百济神州「索托克拉」
申报第 2 个适应症
根据百济神州 Q1 财报,索托克拉用于治疗 R/R MCL 的 Ⅱ 期临床试验预计将进行数据读出。索托克拉用于治疗 R/R MCL 的 Ⅲ 期 CELESTIAL 试验(BGB-11417-302)已完成首例受试者入组。
Insight 数据库显示,全球范围内目前仅有一款 BCL-2 抑制剂获批上市,即艾伯维的维奈克拉,该药已获批用于治疗 CLL/SLL、急性髓系白血病(AML)、MCL。2024 年,该药的销售额已达到 25.83 亿美元。
科伦博泰「芦康沙妥珠单抗」
申报第 4 个适应症
5 月 22 日,科伦博泰芦康沙妥珠单抗的第 4 项上市申请获 CDE 受理,用于治疗既往接受过内分泌治疗且在晚期或转移性阶段接受过其他系统治疗的不可切除的局部晚期或转移性 HR+/ HER2- 乳腺癌成人患者。该适应症已被 CDE 纳入优先审评。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..