本期看点
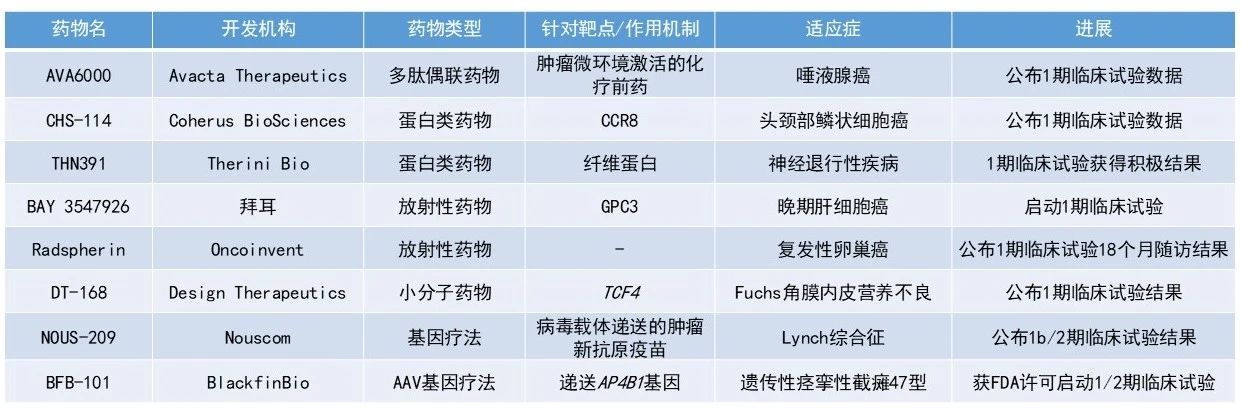
AVA6000:公布1期临床试验结果
Avacta Therapeutics公司日前公布了其主打在研多肽偶联药物AVA6000的1期临床试验积极数据。AVA6000是一种在肿瘤微环境中特异性激活的多柔比星(doxorubicin)前药,旨在减少传统化疗的全身性副作用。在1a期剂量递增研究中,无论是每三周一次(Q3W)还是每两周一次(Q2W)的给药方案,AVA6000均显示出良好的耐受性。即使剂量升高至每三周385 mg/m²,也未达到最大耐受剂量(MTD)。
在唾液腺癌患者(n=11)中,接受≥250 mg/m²剂量水平的AVA6000治疗后,多位患者获得确认缓解,疾病控制率达到91%。中位无进展生存期(PFS)尚未达到,当前中位随访时间已超过25周。
AVA6000是Avacta研发管线中的首个多肽偶联药物,由多柔比星与Avacta专有的pre|CISION多肽偶联而成,该多肽可在肿瘤微环境中由成纤维细胞激活蛋白-α(FAP)特异性切割。FAP在大多数实体瘤中,与健康组织相比表达水平显著升高。Avacta的多肽偶联药物利用这一特征在肿瘤微环境中特异性释放活性药物,从而降低系统暴露和毒性,为患者提供更好的治疗效果。
CHS-114:公布1期临床试验结果
Coherus BioSciences公布了其正在进行的1期临床试验的更新数据,该试验旨在评估选择性抗CCR8抗体CHS-114作为单药,以及与toripalimab联用,治疗复发/转移性头颈部鳞状细胞癌(HNSCC)患者的活性,以优化给药方案。
数据显示,一例经过多线治疗且对PD-1抑制剂耐药的患者获得确认部分缓解,同时CCR8阳性调节性T细胞(Treg)减少超过50%、CD8阳性效应T细胞数量增加,与抗肿瘤活性一致,证明了药物的作用机制。这些数据支持继续评估CHS-114与包括toripalimab在内的其他疗法联用,并支持推进该研究第3部分的患者招募与开展,以进一步评估CHS-114与toripalimab在HNSCC中的疗效。
CHS-114是一种去岩藻糖化的CCR8单克隆抗体,能优先杀伤肿瘤微环境中的CCR8阳性Treg,同时保留正常组织中的CD8阳性效应T细胞和Treg。
Radspherin:公布1期临床试验18个月随访结果
Oncoinvent日前公布了其1期临床试验RAD-18-001的18个月随访结果。该试验在铂敏感复发性卵巢癌合并腹膜癌转移患者中评估放射性疗法Radspherin的效果,该试验于2023年底完成患者招募,目前患者正接受长期随访。
在本试验中,10例患者接受了单次腹腔内Radspherin给药。Oncoinvent在2024年11月公布的12个月数据中,10例患者中仅1例出现腹膜复发。18个月随访时,未见新增复发病例,即迄今为止仅10%的患者出现复发。而在类似人群中,接受最佳标准治疗的患者在同一随访时点预计约有40%的复发率。
Radspherin是一种在研放射性药物,旨在局部治疗已扩散至体腔的癌症。它由数十亿个含放射性同位素镭-224的碳酸钙微粒组成。其作用机制是镭-224衰变发射的α粒子,这是一种高效能的电离辐射形式。Radspherin用于治疗卵巢癌和结直肠癌引起的腹膜癌转移,在外科切除所有可见肿瘤后,通过腹腔内给药。
DT-168:公布1期临床试验积极数据
Design Therapeutics公司日前公布了在研药物DT-168在健康志愿者中开展的1期单次及多次递增剂量(SAD/MAD)试验的积极数据。DT-168是一种新型GeneTAC小分子药物,制剂为滴眼液,旨在选择性靶向并降低导致角膜内皮细胞功能障碍的突变TCF4基因的表达,从而治疗Fuchs角膜内皮营养不良(FECD)。
这项试验旨在评估DT-168滴眼液的安全性、耐受性和系统药代动力学(PK)。试验结果显示,DT-168滴眼液在所有受试者中均耐受良好。未观察到严重不良事件,也无眼部相关不良事件(AEs),亦无因不良事件导致的停药。所有观察到的不良事件均被研究者判定为与DT-168无关。PK分析结果表明,在所有时间点和所有剂量组中,受试者的系统性暴露均低于定量检测的下限。
基于上述发现,Design公司计划开展DT-168的2期生物标志物临床试验,评估其在FECD患者中的安全性、耐受性及角膜内皮生物标志物表现。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..