4月16日,中国国家药监局药品审评中心(CDE)官网最新公示,礼来公司(Eli Lilly and Company)申报的米吉珠单抗注射液(mirikizumab)以及其皮下注射剂型的新适应症上市申请获得受理。公开资料显示,这是礼来研发的IL-23抑制剂,该疗法曾被Evalulate列为10大潜在重磅疗法之一。该药在中国的首个上市申请于去年10月获得CDE受理,针对适应症为克罗恩病。根据公开资料推测,本次该药申报上市的适应症为可能为治疗中重度活动性溃疡性结肠炎(UC)成人患者。
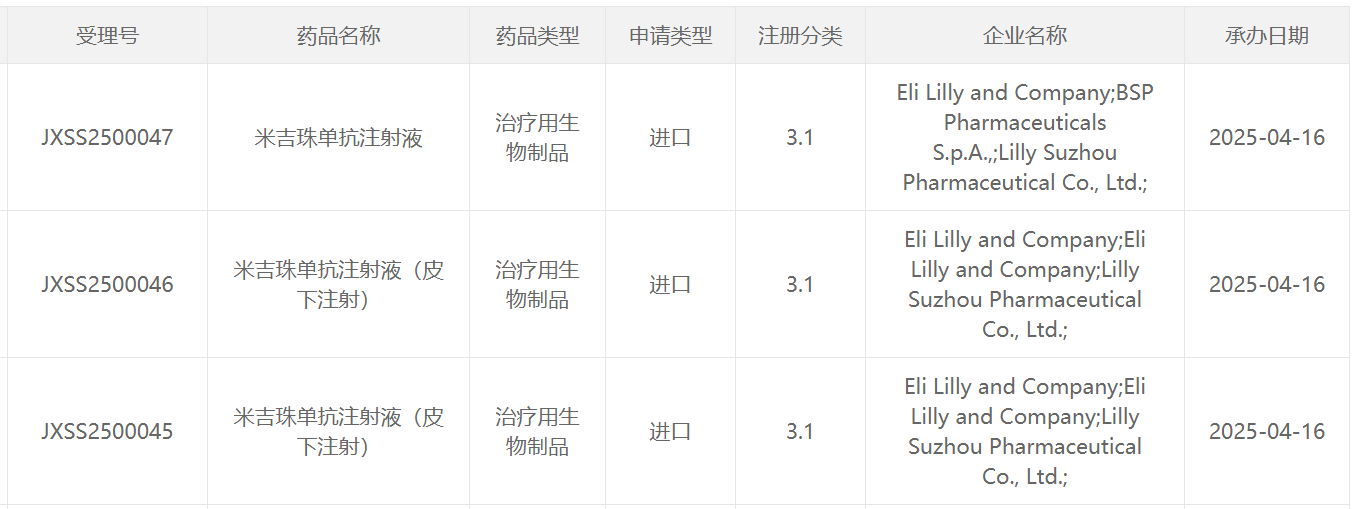
截图来源:CDE官网
米吉珠单抗是一款人源化IgG4单克隆抗体,可与IL-23的p19亚基结合,阻断IL-23介导的炎症反应。作为一种炎性细胞因子,IL-23参与了多个炎症相关的生理过程,被认为与许多免疫介导的慢性疾病有关,也因此成为了许多自身免疫性疾病的治疗靶点。
2023年10月,美国FDA批准米吉珠单抗用于治疗中重度活动性溃疡性结肠炎(UC)成人患者。根据礼来此前新闻稿,这是首个用于治疗这一患者群体的IL-23p19拮抗剂。该产品治疗溃疡性结肠炎开始时静脉输注300毫克,每4周输注一次,共输注3次,在维持治疗期间,每4周进行两次100毫克皮下注射。2025年1月,米吉珠单抗再次获FDA批准,用于治疗成人中度至重度活动性克罗恩病(CD)。
从临床研究数据来看,米吉珠单抗用于治疗中重度活动性溃疡性结肠炎的两项3期临床研究已经取得积极结果,包括一项为期12周的诱导治疗研究(UC-1)和一项为期40周的维持治疗研究(UC-2)。
试验结果显示,米吉珠单抗治疗12周后,65%的患者获得临床应答,24%的患者获得临床缓解。安慰剂组的临床应答和临床缓解率分别为43%和15%。在12周达到临床缓解的患者中,66%的患者在连续治疗1年期间维持临床缓解,安慰剂组这一数值为40%。根据事后分析,几乎所有(99%)在1年时达到临床缓解的患者在52周评估结束前至少3个月不使用类固醇。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..