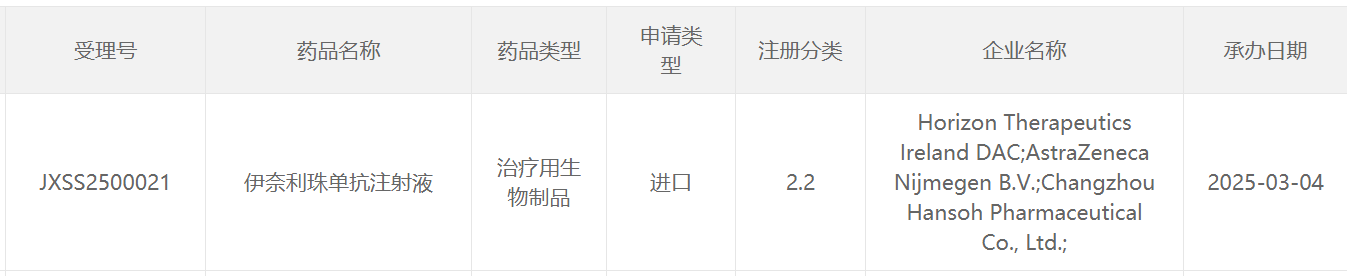
 截图来源:CDE官网
截图来源:CDE官网
IgG4-RD是一种慢性、全身性、免疫介导的纤维炎症性疾病,可影响身体的多个器官。B细胞在IgG4-RD的发病机制中起核心作用。在IgG4-RD中,表达CD19(CD19+)的B细胞被认为驱动炎症和纤维化过程,并与其他参与疾病活动的免疫细胞相互作用。
伊奈利珠单抗(inebilizumab)是靶向CD19 B细胞消耗性抗体。2019年,翰森制药与Viela Bio订立许可协议,获得于中国内地、香港和澳门地区开发及商业化该产品的独家许可(Viela Bio于2021年被Horizon Therapeutics收购,后者于2023年被安进收购)。伊奈利珠单抗此前已经在美国和中国获批上市,用于治疗抗水通道蛋白4(AQP4)抗体阳性的视神经脊髓炎谱系障碍(NMOSD)成人患者。
今年2月,翰森制药宣布伊奈利珠单抗注射液用于IgG4-RD新适应症正式被CDE纳入优先审评。这是基于其全球关键性3期试验MITIGATE的积极结果。2024年11月,该数据已发表于《新英格兰医学杂志》(NEJM)。2024年8月,FDA已根据MITIGATE的研究数据授予伊奈利珠单抗用于IgG4相关性疾病的突破性疗法认定,目前相关监管手续正在申报中。
MITIGATE研究在包括中国在内的22个国家的80个临床试验研究中心进行。研究关键发现包括:
在52周安慰剂对照期内,与安慰剂相比,接受伊奈利珠单抗治疗的受试者IgG4-RD复发风险显著降低了87%,具有临床意义及统计学意义;接受伊奈利珠单抗治疗的68名受试者中有7人出现复发,而接受安慰剂治疗的67名受试者中有40人出现复发。
在安慰剂对照期间,接受治疗并经裁定委员会确定的年化复发率降低;接受伊奈利珠单抗治疗的受试者为0.10,而接受安慰剂的受试者为0.71。
57.4%(39/68)接受伊奈利珠单抗治疗的受试者在第52周时达到无复发、无需治疗的完全缓解,而安慰剂组为22.4%(15/67)。
58.8%(40/68)接受伊奈利珠单抗治疗的受试者在第52周时达到了无复发、无需皮质类固醇的完全缓解,而安慰剂组为22.4%(15/67)。
该研究验证了伊奈利珠单抗的独特作用机制,能够快速并持续地耗竭外周B细胞的数量,从而降低疾病生物标志物的水平。
研究数据还显示,89.7%(61/68)接受伊奈利珠单抗治疗的受试者在安慰剂对照期间不需要使用糖皮质激素来控制疾病,而安慰剂组的比例为37.3%(25/67)。第8周后,伊奈利珠单抗治疗组受试者的总糖皮质激素用量比安慰剂组减少了10倍。安慰剂对照期的安全性结果与伊奈利珠单抗已知的安全性特征一致。
除了IgG4-RD适应症,安进(Amgen)还正在开发伊奈利珠单抗治疗重症肌无力,相关3期临床试验也已经于近期达到了主要终点;以及治疗系统性红斑狼疮伴肾炎,目前正处于2期临床研究阶段。期待该产品后续更多临床研究顺利,早日惠及更多患者。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..