疾病控制率达90%的创新疗法;靶点作用率达95%的PI3Kα共价抑制剂…… | 一周盘点
发布时间: 2025-01-21 来源: 药明康德
1. 多肽偶联药物(PDC)AVA6000在治疗唾液腺癌(SGC)患者的1a期临床试验中获得积极数据,疾病控制率(DCR)达90%。2. 蛋白降解药物BHV-1400在首个人体临床试验中获得积极结果,在最低剂量下只需一次注射,就可在4小时内将致病抗体水平降低60%。3. PI3Kα共价抑制剂TOS-358在一项1期临床试验中对PI3Kα的靶点作用率达到95%。
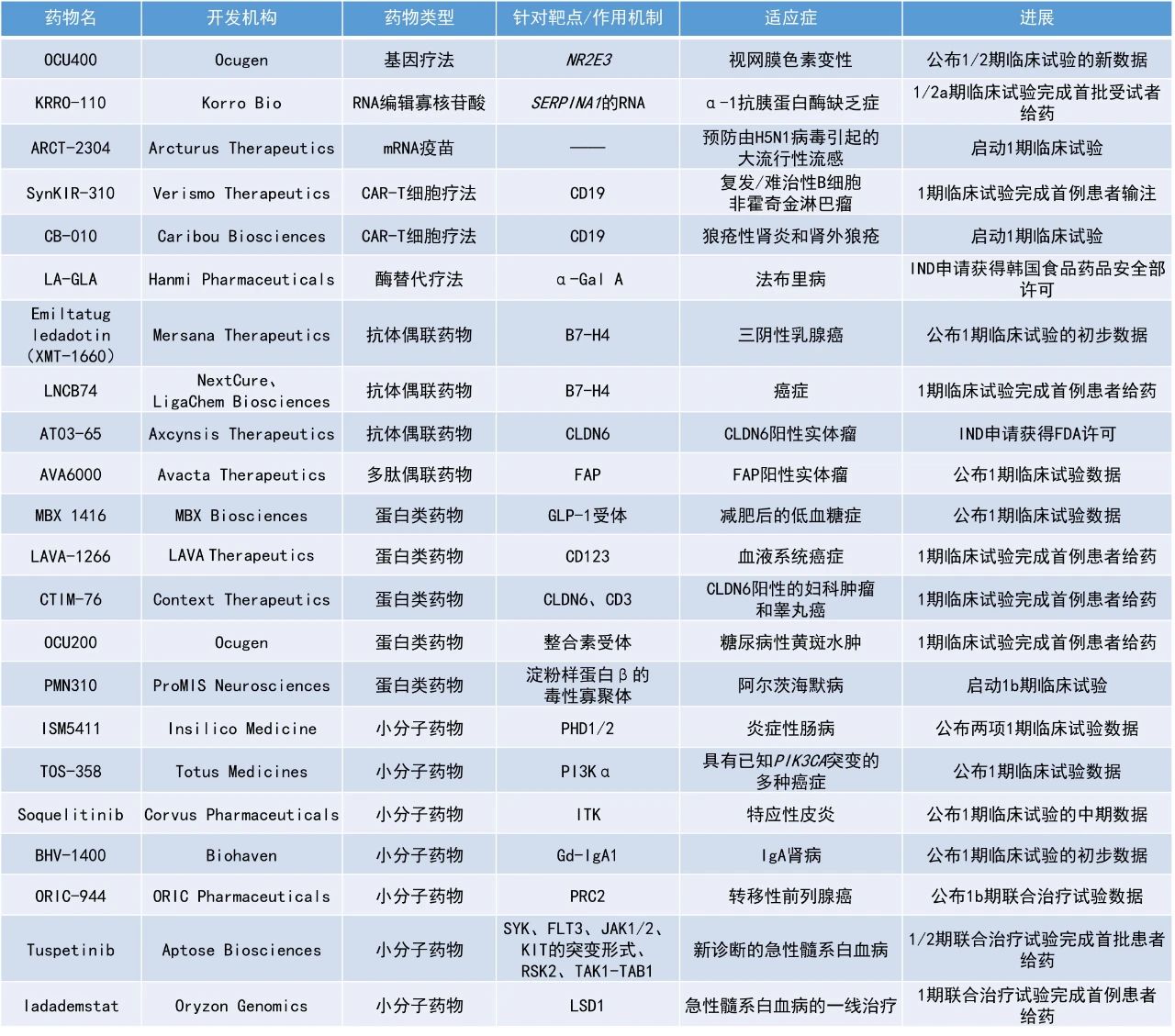
Avacta Therapeutics公司宣布,其在研多肽偶联药物AVA6000在治疗唾液腺癌患者的1a期临床试验中获得积极数据。唾液腺癌是一种在转移性阶段尚无标准治疗方案的疾病。AVA6000是Avacta研发管线中的首个多肽偶联药物,由阿霉素(doxorubicin)与Avacta专有的pre|CISION多肽偶联而成,该多肽可在肿瘤微环境中由成纤维细胞激活蛋白-α(FAP)特异性切割。FAP在大多数实体瘤中,与健康组织相比表达水平显著升高。Avacta的多肽偶联药物利用这一特征在肿瘤微环境中特异性释放活性药物,从而降低系统暴露和毒性,为患者提供最佳治疗效果。此次公布的数据显示,AVA6000在唾液腺癌患者中实现了显著且具有临床意义的肿瘤缩小。在接受250 mg/m²及以上剂量治疗的10名唾液腺癌患者中,DCR达90%,5名患者肿瘤显著缩小,其中包括一例部分缓解(PR,肿瘤缩小45%)和四例轻微缓解(MR,肿瘤缩小10%-19.5%)。安全性方面,在每两周一次和每三周一次两个剂量组中,AVA6000的耐受性良好,与常规剂量阿霉素相比,其血液学和心脏毒性明显降低。目前尚未在任一剂量组中确定最大耐受剂量(MTD)。Biohaven公司公布了其蛋白降解药物管线中的双特异性分子BHV-1400的最新结果。BHV-1400是一款基于耶鲁大学(Yale University)的MoDE技术的双特异性分子,它的一端与半乳糖缺乏型IgA1(Gd-IgA1)抗体结合,另一端与肝细胞表面的去唾液酸糖蛋白受体(ASGPR)结合。ASGPR介导肝细胞通过内吞过程,将靶点蛋白吞入细胞内进行降解。IgA肾病是由于Gd-IgA1的过度生产造成的,BHV-1400通过降低血液循环和肾脏中的Gd-IgA1水平,有望从根源治疗IgA肾病。此次公布的初步数据显示,BHV-1400在首个人体临床试验中获得积极结果,在最低剂量下只需一次注射,就可在4小时内将致病抗体水平降低60%。在某些患者中,观察到在8小时内将Gd-IgA1水平降低70%。此外,Gd-IgA1水平的降低在单次注射后可维持数天。安全性方面,迄今为止,BHV-1400在1期临床试验中的安全性和耐受性良好,未发现具有临床意义的先天和适应性免疫力的变化,并且未观察到剂量限制性毒性。这项研究将继续提高BHV-1400的剂量,探索降低Gd-IgA1水平的范围。基于该研究的积极结果,该公司还计划直接启动关键性临床试验,评估BHV-1400治疗IgA肾病的疗效和安全性。Totus Medicines公司公布了其在研PI3Kα共价抑制剂TOS-358的1期临床试验数据。TOS-358是一款具高度特异性、强效的PI3Kα抑制剂,可在临床前模型中实现近100%的PI3Kα抑制,诱导带有PI3Kα突变的异种移植实体瘤的细胞死亡,包含结直肠癌、肺癌、乳腺癌、卵巢癌、食管癌、头颈癌,且几乎没有观察到非靶向抑制。此次公布的研究结果表明,TOS-358在低至5 mg每日两次(BID)的剂量下具有泛突变临床活性,对PI3Kα的靶点作用率达到95%,且观察到未经确认的完全缓解(CR)。安全性方面,未报道3/4级毒性。值得注意的是,几名接受给药的患者现在已超过6个月未发生进展。在成功完成1期剂量递增研究后,该公司现在启动了一项扩展研究,针对乳腺癌、子宫内膜癌、尿路上皮癌和头颈癌。ORIC Pharmaceuticals公司公布了其选择性PRC2别构抑制剂ORIC-944联用阿帕鲁胺治疗转移性去势抵抗性前列腺癌(mCRPC)的1b期临床试验数据。截至2024年12月10日的数据,6例患者中有3例达到确认的PSA50应答(即PSA水平降低50%),其中2例达到确认的PSA90应答。所有PSA应答均维持≥12周,其中包括一例在38周时仍然持续的、确认的PSA90应答。Soquelitinib:公布1期临床试验的中期数据Corvus Pharmaceuticals公司公布了其小分子白细胞介素-2诱导的T细胞激酶(ITK)抑制剂soquelitinib用于治疗中度至重度特应性皮炎的1期临床试验的新中期数据。ITK是一种主要表达于T细胞中的酶,在T细胞和自然杀伤(NK)细胞的免疫功能中起重要作用。通过抑制ITK,soquelitinib有望抑制自身免疫和炎症反应。此次公布的结果显示,与安慰剂相比,soquelitinib治疗组在研究者总体评估(IGA)评分为0/1(皮肤症状清除或几乎清除)和湿疹面积和严重度指数较基线减少75%(EASI 75)这些临床终点方面显示出良好的疗效特征。在soquelitinib组的19例患者中,26%的患者达到IGA 0/1,37%的患者达到EASI 75。在安慰剂组的7例患者中,没有人达到IGA 0/1,也没有人达到EASI 75。安全性方面,未观察到明显的安全问题,也未发现临床上显著的实验室检测异常。英矽智能(Insilico Medicine)公司宣布,其自主研发的候选药物ISM5411已完成在澳大利亚和中国开展的两项1期研究,并取得了积极的初步结果。ISM5411是一种潜在用于治疗炎症性肠病(IBD)的小分子抑制剂,靶向PHD1/2靶点且具有新颖的分子结构,该候选药物设计和优化得到了英矽智能生成化学平台Chemistry42的支持。此次公布的结果显示,在所有剂量组中ISM5411均表现出良好的安全性和耐受性,并初步验证了肠道限制性药代动力学(PK)特征。基于1期临床试验的积极结果,英矽智能预计将于2025年下半年启动一项评估ISM5411在活动性溃疡性结肠炎患者中的2期临床试验。MBX Biosciences公司公布了在健康成年受试者中开展的MBX 1416单剂量递增和多剂量递增临床试验的积极结果。MBX 1416是一种长效胰高血糖素样肽1(GLP-1)受体拮抗剂,用于治疗减肥后的低血糖症(PBH)。MBX 1416采用MBX公司新颖、专有的精准内分泌肽(PEP)平台设计,旨在防止PBH患者发生严重低血糖,使他们能够过上更健康、更独立的生活。此次公布的结果显示,MBX 1416通常安全性和耐受性良好,并且具有良好的药代动力学特征,支持每周一次给药。基于这些结果,该公司计划于2025年下半年在PBH患者中启动一项2期研究,以进一步优化剂量。
