1月8日,中国国家药监局药品审评中心(CDE)官网公示,科伦博泰申报的1类新药注射用博度曲妥珠单抗的第二项适应症上市申请已获得受理。这是一款靶向人类表皮生长因子受体 2(HER2)的抗体偶联药物(ADC)(此前称A166)。根据科伦博泰今日发布的新闻稿介绍,本次该产品申报上市的适应症为用于既往至少接受过一种抗HER2治疗的HER2阳性不可切除或转移性乳腺癌成人患者的治疗。
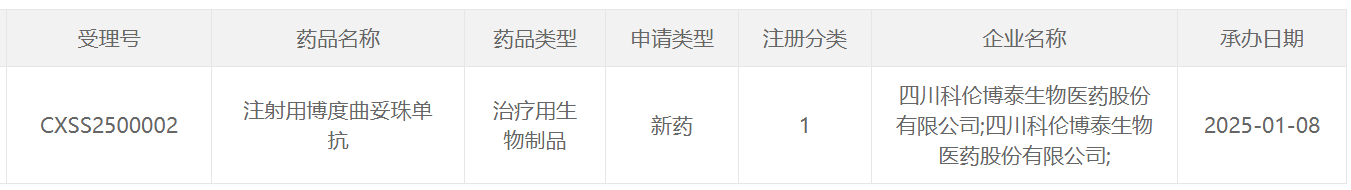
截图来源:CDE官网
博度曲妥珠单抗是科伦博泰研发的创新靶向HER2的ADC,其通过稳定酶可裂解连接子将新型MMAF衍生物(高细胞毒性微管蛋白抑制剂Duo-5)与HER2单克隆抗体偶联,药物抗体比(DAR)为2。博度曲妥珠单抗特异性结合肿瘤细胞表面的HER2,并被肿瘤细胞内吞,在胞内释放毒素分子Duo-5,Duo-5诱导肿瘤细胞周期阻滞在G2/M期,引起肿瘤细胞凋亡。博度曲妥珠单抗靶向结合HER2后也可抑制HER2介导的信号通路,具有抗体依赖细胞介导的细胞毒作用(ADCC)活性。
据科伦博泰官网介绍,根据主要分析结果,博度曲妥珠单抗已达到其针对3L+晚期HER2阳性乳腺癌的关键2期试验的主要终点,并于2023年5月向NMPA递交首个上市申请。
本次是该产品的第二项上市申请,适应症为用于2L+晚期HER2阳性乳腺癌。根据科伦博泰新闻稿介绍,本次上市申请是基于一项多中心、随机、开放、对照、3期KL166-III-06临床研究,该研究评估了博度曲妥珠单抗单药对比恩美曲妥珠单抗(T-DM1)在既往接受过曲妥珠单抗和紫杉类治疗的HER2阳性不可切除或转移性乳腺癌患者中的疗效和安全性结果。在预设的期中分析中,与对照药相比,博度曲妥珠单抗单药在主要研究终点盲态独立中心评估(BICR)评估的无进展生存期(PFS)方面具有显著统计学意义和临床意义的改善。
此前在2022年美国临床肿瘤学会(ASCO)年会上,研究人员公布了博度曲妥珠单抗用于经过多线治疗的HER2+乳腺癌患者的1期剂量扩展研究的更新数据,4.8mg/kg组客观缓解率(ORR)达73.9%,中位无进展生存期(PFS)达12.3个月,不良反应可控,博度曲妥珠单抗疗效和安全性再次得到验证。
除了上述适应症,科伦博泰还在中国开展了A166针对其他晚期HER2阳性实体瘤的1b期临床试验。希望这款ADC新药后续注册和研究进程顺利,早日为患者带来新的治疗选择。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..