1. γ9δ2 T细胞激活剂ICT01联用阿扎胞苷和维奈托克治疗新确诊的老年和/或不适合标准治疗的急性髓系白血病(AML)患者,总完全缓解(CR)率达75%。
2. 治疗实体瘤软脑膜转移(LM)的放射治疗药物Rhenium(186Re)obisbemeda与标准的外照射放疗相比,可使中枢神经系统(CNS)蛛网膜下腔吸收的辐射剂量提高多达8倍。
3. 细胞疗法TED-A9在治疗帕金森病的1/2a期临床试验中表现亮眼,高剂量组所有3名患者的步态冻结症状完全消失。
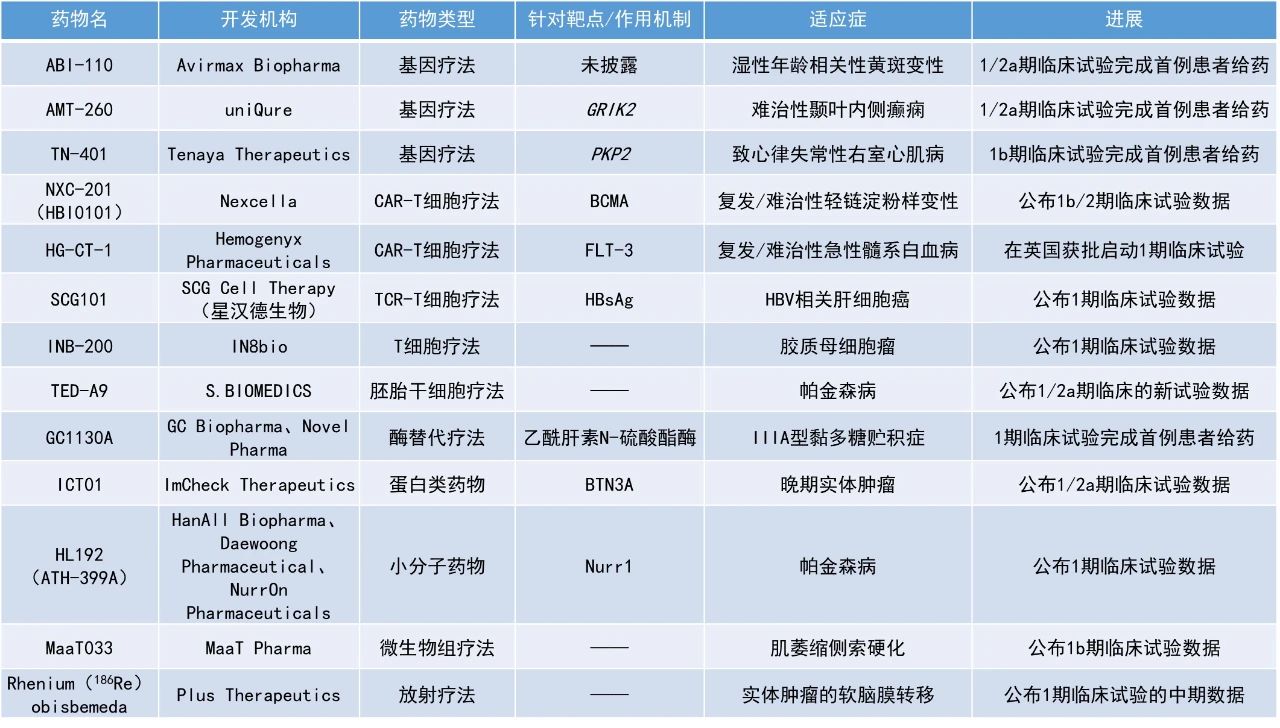
ImCheck Therapeutics公司公布了其新型γ9δ2 T细胞激活剂ICT01联用阿扎胞苷和维奈托克治疗新确诊的老年和/或不适合标准治疗的AML患者的积极1/2a期临床试验数据。γ9δ2 T细胞是先天免疫系统的一部分,负责对肿瘤和感染的免疫监察。ICT01是一款靶向嗜乳脂蛋白家族成员BTN3A的单克隆抗体疗法,通过与BTN3A结合,它可以选择性地激活γ9δ2 T细胞,并且促进它们迁移和浸润肿瘤,进一步激发CD8阳性T细胞和自然杀伤细胞的抗肿瘤反应。截至2024年7月19日的数据,16名疗效可评估患者的中位随访时间为4.0个月(范围0.7-7.4个月),总CR率为75%,CR/伴有血液学不完全恢复的完全缓解(CRi)率为94%。第1、2、3和4个治疗周期结束时达到CR/CRi的患者比例分别为44%、81%、88%和94%。总体而言,缓解持续时间为2.5个月,截至数据截止日期患者仍然在持续缓解。中位总生存期数据尚未成熟。Rhenium(186Re)obisbemeda:公布1期临床试验的中期数据Plus Therapeutics公司公布了其主打放射治疗药物Rhenium(186Re)obisbemeda治疗实体瘤软脑膜转移的临床试验ReSPECT-LM的最新数据。该疗法是一款新型可注射放疗药物,专门配制用于以安全、有效和方便的方式在CNS肿瘤中递送专一靶向的高剂量辐射,以优化患者临床结局。由于186Re的半衰期短,具有破坏癌组织的β放射能和可用于活体成像的γ放射能,是CNS治疗应用的理想放射性同位素。20名患者接受了治疗,包括9名原发癌症为乳腺癌的患者,5名原发癌症为非小细胞肺癌的患者,以及6名原发癌症为其他癌症的患者。此次公布的结果显示,治疗后112天时,93%(14/15)患者的脑脊液循环肿瘤细胞(CTC)显示有缓解,包括1例CR和1例疾病稳定(SD)。磁共振成像(MRI)结果显示,75%(12/16)的患者获得缓解或SD,包括5例缓解和7例SD。临床应答结果显示,86%(12/14)的患者获得缓解或SD,包括2例部分缓解(PR)和10例SD。队列1-4组患者的中位总生存期为9个月,16名患者中有6人在分析时仍存活。此外,有3名患者在“同情使用”项目下接受了3次给药,这3名患者的生存时间均超过400天,其中1名患者甚至超过了30个月。新闻稿还指出,与标准的外照射放疗相比,该治疗方法可使CNS蛛网膜下腔吸收的辐射剂量提高多达8倍。
S.BIOMEDICS公司宣布了其细胞疗法TED-A9在治疗帕金森病的1/2a期临床试验中的首批6名受试者的1年随访数据。TED-A9是一款通过对人类胚胎干细胞(hESC)进行小分子化合物处理而生成的高度纯化中脑多巴胺能祖细胞。通过外科手术,hESC衍生的多巴胺能祖细胞被移植到患者双侧壳核的前、中、后部。移植后,这些细胞将成熟为多巴胺能神经元,通过增强帕金森病患者的神经连接,有望恢复患者的运动功能。
此次公布的结果显示,根据Hoehn和Yahr量表,低剂量组(n=3)患者的运动症状平均改善了19.4%,而高剂量组(n=3)改善了44.4%,表明疾病状态从严重转向较轻。步态冻结(帕金森病患者常见的运动症状之一)在低剂量组的部分患者(1/2)中完全消失,在高剂量组的所有患者(3/3)中完全消失。神经影像技术结果显示,由移植细胞形成的突触中多巴胺转运蛋白(DAT)增加,高剂量组更为明显。安全性方面,没有观察到与移植细胞相关的问题。
IN8bio公司公布其耐化疗的转基因自体γδ T细胞疗法INB-200加入到胶质母细胞瘤患者的替莫唑胺(TMZ)维持治疗中的1期临床试验数据。INB-200是一种强大的协同治疗方法,能在患者接受化疗时持续存在,并保持其识别和杀死癌细胞的能力。此次公布的结果显示,92%接受INB-200协同治疗的可评估患者的无进展生存期(PFS)超过了接受标准治疗(Stupp方案)患者的中位PFS(6.9个月),大多数患者的PFS超过了基于年龄和肿瘤MGMT状态预测的PFS。此外,5名患者仍然存活,3名患者已返回工作岗位,其中1名患者在治疗后40.5个月时疾病仍然没有进展。活检结果显示,两名患者在接受INB-200治疗后,脑肿瘤微环境中持续存在着γδ T细胞以及CD3阳性和CD8阳性T细胞。安全性方面,任何队列中均未报告与治疗相关的严重不良事件、剂量限制性毒性(DLT)、细胞因子释放综合征(CRS)、输注反应或免疫效应细胞相关神经毒性(ICAN)。最常见的治疗相关不良事件是1-2级毒性,包括与标准护理TMZ相关的白细胞和血小板计数下降。
星汉德生物(SCG Cell Therapy)公布了其自主研发的乙型肝炎病毒(HBV)特异性T细胞受体(TCR)-T细胞疗法SCG101的1期临床试验的新数据。SCG101是一种靶向乙型肝炎病毒表面抗原(HBsAg)的特异性自体TCR-T细胞疗法。星汉德生物依托自主研发的独有GianT技术平台,筛选高亲力且高活性的天然TCR,可以有效靶向实体肿瘤中通过主要组织相容性复合体(MHC)表达的细胞内抗原。临床前和临床研究数据显示,SCG101具有肿瘤抑制和HBV共价闭合环状DNA(cccDNA)根除作用,可实现抗肿瘤和抗病毒功能。此次公布的结果显示,SCG101在晚期HBV相关肝细胞癌(HCC)患者中显示出有希望的抗病毒活性。在接受单次静脉注射5.0×10^7-1.0×10^8个TCR-T细胞/kg剂量的SCG101治疗的12名患者中,所有患者的血清HBsAg水平均显著下降,其中11名患者(92%)的HBsAg水平下降了1.0-4.6 log10,并且在整个长达一年的随访期间,这些患者的HBsAg水平保持在100 IU/mL以下。值得注意的是,有4名患者(33%)在接受单次SCG101输注后的21天内实现了HBsAg的消失,并且这种状态持续了一整个随访期。SCG101的安全性总体上良好,治疗耐受性良好。最常见的治疗相关不良事件包括暂时性的肝酶升高、发热、细胞减少症、CRS、低白蛋白血症和低钠血症。HL192(ATH-399A):公布1期临床试验数据HanAll Biopharma公司、Daewoong Pharmaceutical公司和NurrOn Pharmaceuticals公司成功完成了HL192(ATH-399A)的1期研究。HL192(ATH-399A)是一种用于治疗帕金森病的Nurr1激活剂,此前已在健康受试者中完成了一项1期研究。此次公布的结果显示,该研究在5个不同的剂量组中达到了安全性和耐受性的主要终点,表明在治疗这种使人衰弱的神经系统疾病方面迈出了有意义的一步。HL192(ATH-399A)的耐受性良好,76名受试者均无重大安全问题。接受治疗的患者与接受安慰剂的患者在治疗伴发不良事件上的发生率相当,没有明确的剂量依赖性趋势。药代动力学结果支持每天一次的给药方案。MaaT Pharma公司宣布,其评估MaaT033在肌萎缩侧索硬化(ALS)患者中疗效的1b期临床试验IASO已达到主要终点。ALS患者连续服用MaaT033两个月后显示出良好的安全性和耐受性。初步的微生物组分析证实了MaaT033已成功移植,进一步支持了其安全性和耐受性结果。MaaT033是一种源自供体、高浓度、高多样性的口腔微生物群生态系统疗法(Microbiome Ecosystem Therapy),目前正作为一种辅助疗法进行开发,以提高接受造血干细胞移植(HSCT)和其他细胞疗法的患者的总生存率。此前,MaaT033已被欧洲药品管理局(EMA)授予孤儿药资格。
