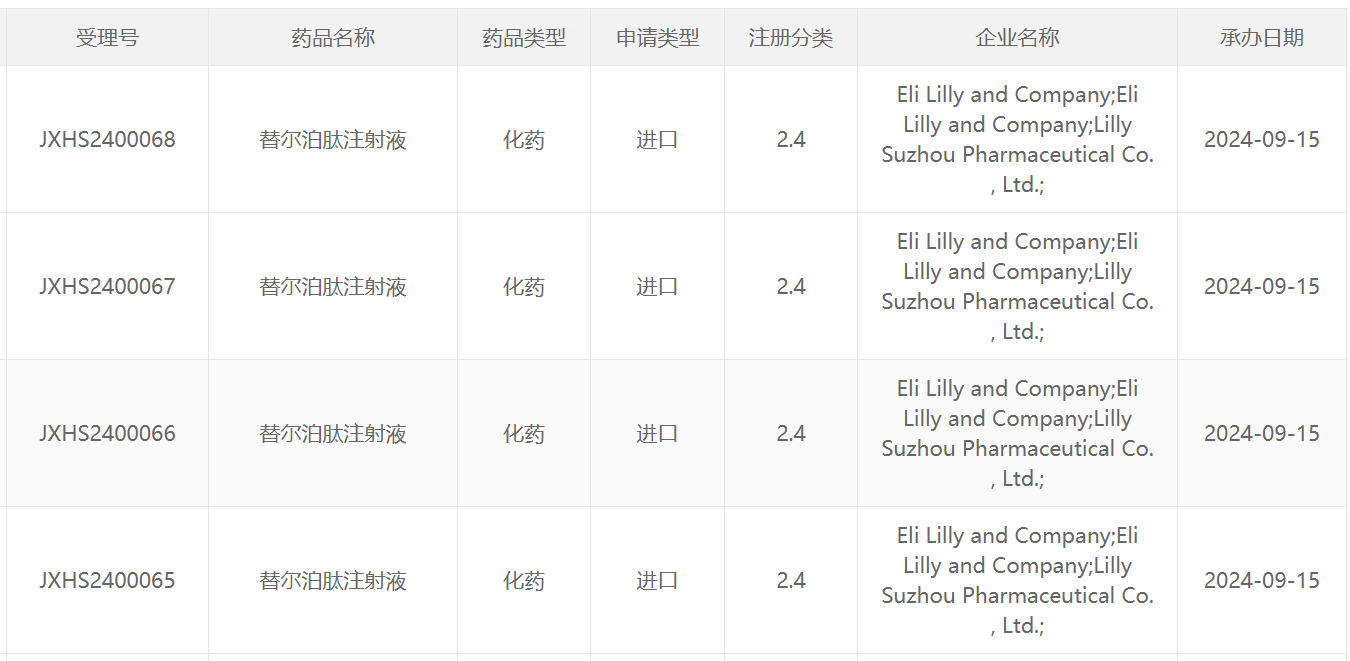
 截图来源:CDE官网
截图来源:CDE官网
今年8月初,礼来还公布替尔泊肽的国际多中心(含中国)临床3期试验(SUMMIT研究)达到积极顶线结果。分析显示,试验达成主要终点,与安慰剂相比,替尔泊肽注射液可将肥胖射血分数保留型心力衰竭(HFpEF)患者发生心衰相关事件的风险降低38%。礼来表示计划从今年晚些时候开始向美国FDA和其他监管机构提交SUMMIT研究的结果。值得一提的是,SUMMIT试验在中国的部分也已经完成,中国入组了55名受试者。
根据药物临床试验登记与信息公示平台官网,替尔泊肽还有多项3期临床研究已经在中国开展,针对适应症包括:用于成人超重和肥胖患者的药物干预治疗,降低其主要心血管事件的风险,减少2型糖尿病发生风险和改善肾脏结局;降低二型糖尿病伴心血管疾病风险增加的患者的主要不良心血管事件(MACE)的复合结局等。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..