获得突破性疗法认定的药物可以继续得到加速批准或传统完全批准;虽然 FDA 要求对获得加速批准的药物执行上市后研究,但对于获得完全批准的突破性药物通常不要求开展上市后研究,即使对于使用替代终点获批的药物也是如此。
研究评估了自 2012 年突破性治疗认定计划启动至 2023 年 12 月 31 日期间支持所有 FDA 突破性治疗法批准的关键临床试验中使用的主要终点。研究人员还审查了 FDA 是否要求开展额外的上市后研究以确认基于替代标志物批准的药物的临床疗效。
FDA 越来越多地批准基于替代标志物而不是临床结局作为主要疗效终点的产品。临床结局衡量治疗效果,例如患者感受、功能或生存情况,而替代标记使用实验室测量或影像学结果来“作为衡量临床结局的替代量度标准。”
2013 年至 2023 年间,FDA 批准了 157 个具有突破性治疗认定的产品,其中 52 个(33%)获得加速批准,105 个(67%)获得传统批准。
图1 2013 至 2023 年间获得传统批准的 FDA 突破性治疗认定适应症的终点(n=105)
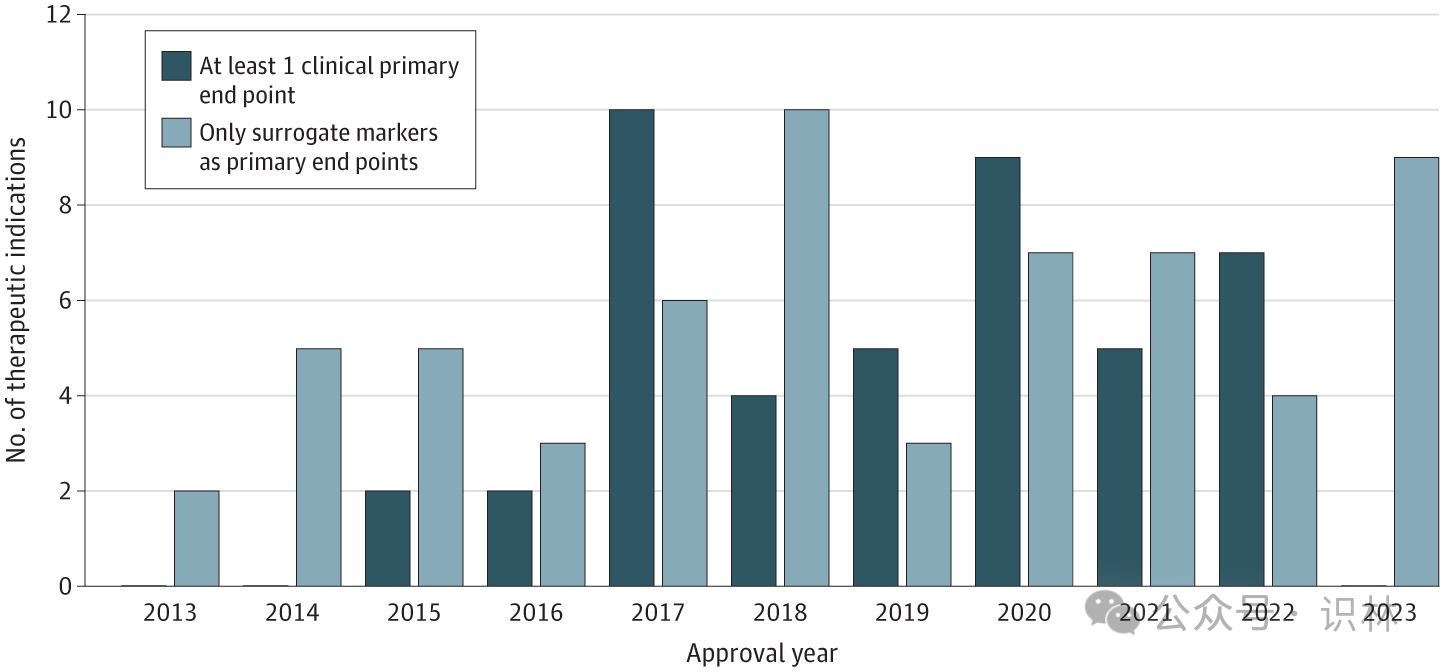
所有加速批准均基于使用替代标志物作为主要终点的关键试验,FDA 要求对这些药物进行上市后研究以确认疗效。超过一半的传统批准 (58%) 是基于依赖替代终点的关键试验,其中只有 4 个 (7%) 需要完成上市后研究来确认疗效。近三分之二 (64%) 获得传统批准的突破性药物依赖于 FDA 认可的针对相同适应症的替代标志物。
研究指出,“对于加速批准,FDA 要求执行上市后研究来确证所有突破性治疗药物指定适应症的预期临床获益,不同的是,基于替代标志物的传统批准通常不伴随 FDA 对上市后疗效研究的要求。”
作者得出的结论是,“有证据表明,很大一部分医生在证据标准方面误解了突破性治疗认定的含义,包括该认定自动获得加速审批的资格。因此,当突破性治疗认定的适应症根据替代终点而不是临床结局获得批准时,如果没有统一的上市后要求来确证获益,可能会妨碍患者和临床医生做出准确和明智的决策。”
[1] Mooghali M, Wallach JD, Ross JS, Ramachandran R. Premarket Pivotal Trial End Points and Postmarketing Requirements for FDA Breakthrough Therapies. JAMA Netw Open. 2024;7(8):e2430486. doi:10.1001/jamanetworkopen.2024.30486
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..