八月,超 10 款抗肿瘤新药在中国申报上市,新适应症拓展竞赛激烈进行中!
发布时间: 2024-09-04 来源: Insight数据库
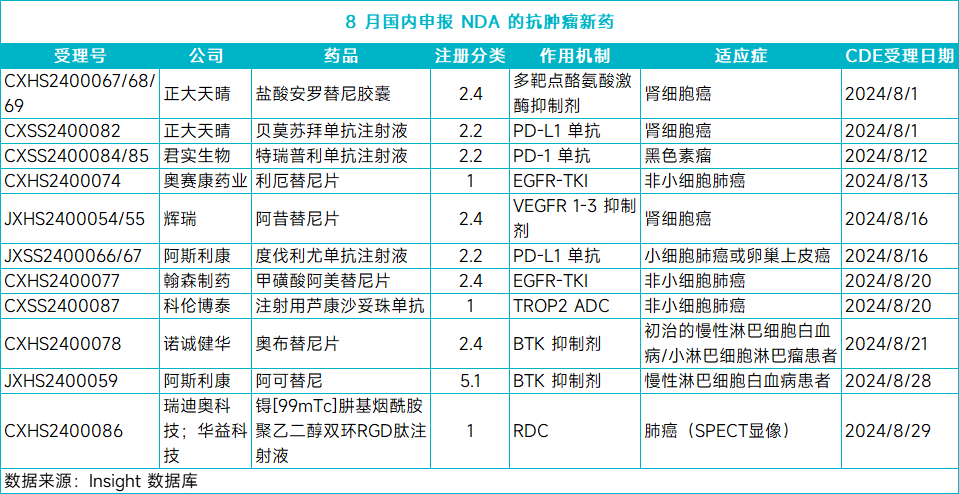
8 月已经结束。根据 Insight 数据库,总计有 25 款新药在八月向 CDE 递交了上市申请,包括 9 款新药的首个 上市申请和 16 款新药的新适应症申请。从治疗领域来看,其中有 11 个为抗肿瘤新药,占到了总数的近 44%。值得一提的是,11 款抗肿瘤新药中,10 款申报的是新适应症,涉及肺癌、白血病、肾细胞癌等多个瘤种。本文将对这些抗肿瘤新药做简要介绍,仅供读者参阅。8 月 20 日,CDE 受理了阿美替尼的第 4 项新适应症上市申请,并将其纳入优先审评,用于治疗含铂根治性放化疗后未出现疾病进展的不可切除的局部晚期 EGFR 外显子 19 缺失或外显子 21(L858R)置换突变的 NSCLC 患者。该申请是基于Ⅲ 期研究 HS-10296-304 的数据,具体研究数据尚未披露。Insight 数据库预测,该申请有望于 2025 年第二季度获批。阿美替尼是第三代 EGFR-TKI,此前已在国内获批两项适应症,分别为:1)用于二线治疗既往经 EGFR-TKI 治疗进展,且 T790M 突变阳性的局部晚期或转移性 NSCLC 患者;2)一线治疗具有 EGFR 外显子 19 缺失或外显子 21(L858R)置换突变阳性的局部晚期或转移性 NSCLC 成人患者。今年 7 月 19 日,CDE 还受理了阿美替尼的第 3 项适应症上市申请,用于具有 EGFR 外显子 19 缺失或外显子 21(L858R)置换突变阳性的 NSCLC 成人患者肿瘤切除术后的辅助治疗。Insight 数据库预测,这项申请也有望于 2025 年第二季度获批。8 月 20 日,CDE 受理科伦博泰 TROP2 ADC 芦康沙妥珠单抗的第 2 项 上市申请,用于治疗经 EGFR-TKI 和含铂化疗治疗失败的局部晚期或转移性 EGFR 突变 NSCLC。该申请已被 CDE 纳入优先审评,Insight 数据库预测该申请有望于明年第三季度获批。
本次上市申请是基于一项多中心、随机、关键临床研究 OptiTROP-Lung03,该试验评估了芦康沙妥珠单抗每两周(Q2W)5 mg/kg 静脉注射对比多西他赛治疗接受 EGFR-TKI 疗法和含铂化疗治疗失败的局部晚期或转移性 EGFR 突变 NSCLC 患者的结果。在预设的分析中,与多西他赛相比,芦康沙妥珠单抗在 ORR 和 PFS 方面均显示出显著统计学意义和临床意义的改善。芦康沙妥珠单抗的首个上市申请 已于 2023 年 12 月获 CDE 受理,用于既往至少接受过 2 种系统治疗的局部晚期或转移性三阴性乳腺癌,Insight 数据库预测该申请有望于今年第四季度获批。8 月 23 日,CDE 受理了奥赛康药业三代 EGFR-TKI 利厄替尼的第 2 个 NDA,用于具有 EGFR 外显子 19 缺失(19DEL)或外显子 21 置换突变(L858R)的局部晚期或转移性 NSCLC 成人患者的一线治疗。Insight 数据库预测该申请有望于 2026 年第三季度获批。该上市申请是基于一项多中心、随机、双盲、阳性对照 III 期临床试验(CTR20191523),该研究旨在评估 ASK120067 片对照吉非替尼一线治疗 EGFR 敏感突变的局部晚期或转移性 NSCLC 患者的有效性和安全性。目前,该 III 期临床试验已达到主要研究终点,具体数据尚未披露。利厄替尼的首个 NDA 于 2021 年 11 月获 CDE 受理,用于既往经 EGFR-TKI 治疗时或治疗后出现疾病进展,并且经检测确认存在 EGFR T790M 突变阳性,或原发性 EGFR T790M 突变阳性的局部晚期或转移性 NSCLC 成人患者的二线治疗,Insight 数据库预测该申请有望于明年一季度获批。8 月 21 日,CDE 受理了诺诚健华 BTK 抑制剂奥布替尼片的新适应症上市申请。根据奥布替尼正在开展的临床研究进度,推测其本次申报的新适应症可能为:初治的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤。Insight 数据库预测该申请有望于明年二季度获批。此前,奥布替尼已在国内获批 3 项适应症,包括:用于既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者以及成人套细胞淋巴瘤(MCL)患者;以及用于治疗复发/难治性边缘区淋巴瘤(MZL)患者。根据诺诚健华 2024 年中期业绩报告显示,奥布替尼今年二季度销售额为 2.53 亿元,去年同期为 1.70 亿元,同比增长 49%。随着新适应症的拓展,该药的销售额有望得到进一步增长。8 月 28 日,CDE 受理了阿斯利康 BTK 抑制剂阿可替尼片的新适应症上市申请。此前,阿可替尼胶囊已在国内获批治疗套细胞淋巴瘤 、单药适用于既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者。根据该药的临床研究进度,推测阿可替尼片本次申请适应症可能为用于一线治疗慢性淋巴细胞白血病患者。Insight 数据库预测该申请有望于明年二季度获批。阿斯利康曾在今年 4 月宣布,在一项由中国牵头的随机、多中心、开放标签 III 期临床试验 ChangE 中,阿可替尼达到了主要终点。试验数据显示,与苯丁酸氮芥和利妥昔单抗联合方案相比,在所有预先指定的亚组中均显示出统计学上显著且临床上有意义的 PFS 改善。与苯丁酸氮芥和利妥昔单抗联合治疗相比,阿可替尼组 OS 益处有改善趋势。8 月 1 日,CDE 受理了正大天晴贝莫苏拜单抗注射液联合盐酸安罗替尼胶囊的新适应症上市申请,用于一线治疗晚期不可切除或转移性肾细胞癌(RCC),Insight 数据库预测该申请有望于明年第二季度获批。贝莫苏拜单抗是 PD-L1 单抗,此前已在国内获批小细胞肺癌一线治疗,并于今年 2 月申报了子宫内膜癌的新适应症 NDA。安罗替尼是一种多靶点酪氨酸激酶抑制剂,此前已在国内获批治疗非小细胞肺癌、软组织肉瘤、小细胞肺癌、甲状腺髓样癌、甲状腺分化癌,本次是其在国内申报上市的第八个适应症。本次的新适应症 NDA 是基于 ETER100 研究(NCT04523272)。这是一项随机、开放、阳性药物平行对照、多中心 III 期临床研究,旨在评估贝莫苏拜单抗联合安罗替尼和对照组一线治疗晚期不可切除或转移性 RCC 的有效性和安全性。研究显示,与对照组相比,贝莫苏拜单抗联合安罗替尼一线治疗晚期 RCC 可显著降低患者的疾病进展或死亡风险,同时可改善 ORR、OS 等次要终点。该研究已入选 2024 年 ESMO 大会的 LBA 摘要,正大天晴届时将会公布研究的具体数据。