8 月 19 日,NMPA 官网公示,安斯泰来递交的 Nectin-4 靶向 ADC 注射用维恩妥尤单抗上市申请已获得批准(JXSS2300022/3),用于治疗既往接受过 PD-1/PD-L1 抑制剂和含铂化疗治疗的局部晚期或转移性尿路上皮癌患者。
Insight 数据库显示,维恩妥尤单抗是全球首个获批的 Nectin-4 靶向 ADC,本次获批也使其成为了首个在国内获批的 Nectin-4 靶向 ADC。

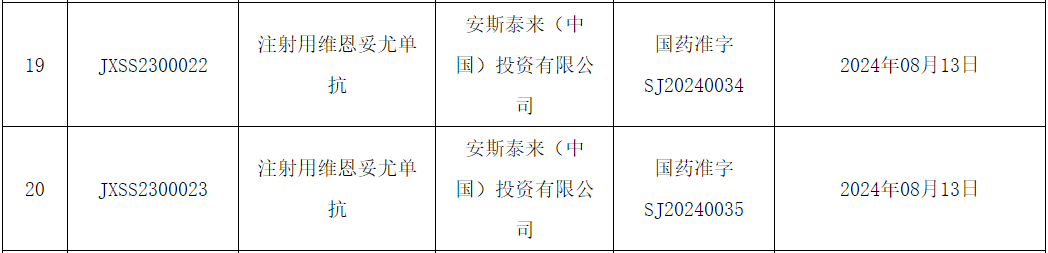 截图来源:NMPA官网
截图来源:NMPA官网
Nectin-4 是位于细胞表面的一种蛋白,在膀胱癌中高度表达。维恩妥尤单抗是直接作用于 Nectin-4 的一种同类首创的抗体偶联药物(ADC),由安斯泰来和辉瑞旗下 Seagen 公司联合开发。
非临床数据显示,维恩妥尤单抗通过与表达 Nectin-4 蛋白的细胞结合,然后将抗肿瘤成分单甲基澳瑞他汀 E(MMAE)内化并释放到细胞中,导致细胞停止增殖(细胞周期阻滞)和程序性细胞死亡(凋亡)来发挥其抗癌活性。此前,该药已在美国、日本和欧盟获批治疗尿路上皮癌。
维恩妥尤单抗在中国的上市申请是基于一项在中国开展的单臂、开放标签、多中心的 II 期桥接临床试验——EV-203 试验(NCT04995419)数据。该试验旨在评估维恩妥尤单抗治疗既往接受 PD-1/PD-L1 抑制剂和含铂化疗治疗的局部晚期或转移性尿路上皮癌的中国患者的疗效、安全性和药代动力学特征。研究共招募了 40 名中国患者,主要终点是独立审查委员会 (IRC) 确认的客观缓解率 (ORR)
在 2023 年 ASCO 大会上,研究人员曾公布了 EV-203 的试验结果。数据显示:
IRC 确认的 ORR 为 37.5%;最佳总体反应为 1 名 (2.5%) 患者完全缓解,14 名 (35.0%) 患者部分缓解;研究者评估的 ORR 为 42.5%。
研究者评估的 DCR 为 82.5%,IRC 评估的 DCR 为 72.5% 。研究者和 IRC 评估的中位 DOR 均未达到。
研究者评估的中位 PFS 为 4.24 个月,IRC 评估的中位 PFS 为 4.67 个月。中位随访时间为 6.5 个月,中位 OS 未达到。
安全性方面,大多数治疗相关不良事件 (TRAE) 为 1-2 级。
EV-203 结果表明,维恩妥尤单抗具有良好的效益风险特征,在中国接受过治疗的局部晚期或转移性尿路上皮癌患者中表现出有意义的临床活性和可控的安全性。
值得一提的是,安斯泰来已于 2024 年 3 月在中国递交了维恩妥尤单抗的第 2 项适应症上市申请:联合 PD-1 抗体帕博利珠单抗用于一线治疗既往未经治疗的局部晚期或转移性尿路上皮癌成年患者。Insight 数据库预测该申请有望于 2025 年第三季度获批。
根据 Insight 数据库,目前国内有十多个 Nectin-4 靶向 ADC 项目在开发中。维恩妥尤单抗之外,研究进度最快的是迈威的 9MW2821,正在开展治疗尿路上皮癌的Ⅲ期临床。此外,恒瑞的 SHR-A2102、石药集团的 SYS6002、科伦博泰的 SKB410、德烽药业/Adcentrx 的 ADRX-0706、百奥泰的 BAT8007 也已进入临床阶段。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..