(收集周期:8.12-8.16,国内部分为首次申请临床、首次申请上市、首次批准上市的创新药)
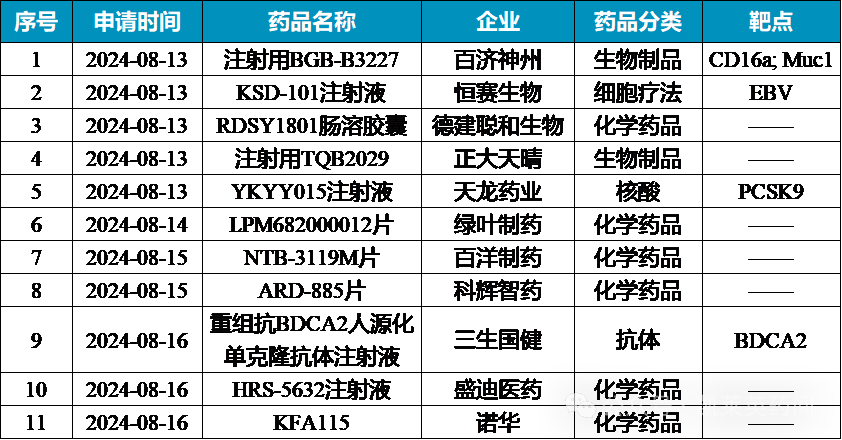
国内创新药IND汇总 1、百济神州:注射用BGB-B3227 作用机制:靶向MUC1/CD16双抗 适应症:肿瘤 8月13日,百济神州的注射用BGB-B3227的临床试验申请(IND)获CDE受理。BGB-B3227是一款靶向MUC1/CD16双抗,被开发用于探索肺癌、胃癌和胆管癌的治疗。MUC1在多种人类上皮恶性肿瘤中过度表达,包括乳腺癌、前列腺癌、卵巢癌、胰腺癌和结肠癌等等,而CD16是免疫球蛋白Fcγ受体家族的重要成员,在自然杀伤细胞(NK细胞)介导的免疫应答中发挥着核心作用。该双抗的差异化优势在于更高的CD16a亲和力。 2、恒赛生物:KSD-101注射液 作用机制:树突细胞疫苗 适应症: 血液肿瘤 8月13日,恒赛生物的KSD-101注射液的IND获CDE受理。KSD-101一款负载EB病毒相关类肿瘤复合抗原的人单核细胞来源自体DC疫苗,通过细胞因子诱导单核细胞转化为树突细胞,再用类肿瘤复合抗原负载树突细胞并诱导其成为成熟的树突细胞;该药物皮下注射后至人体内激活细胞毒性T淋巴细胞(EBV特异性CTL),从而实现对肿瘤细胞的有效识别及杀伤,拟用于开发治疗EBV阳性血液肿瘤。 I期探索性试验显示,在5名可评估的患者中,客观缓解率(ORR)和完全缓解率(CRR)均为100%。注射疫苗后,外周血中多种淋巴细胞和免疫细胞的水平和比例均发生显著性变化,此外EBV特异性CTL的峰值比例显著增加(基线平均0.30% vs.治疗12周平均2.47%)。在安全性上,未发现剂量限制性毒性(DLT)或最大耐受剂量(MTD),最常见的不良反应包括发热(1~2级)、注射部位反应(1级)、淋巴结肿大(1级)和淋巴细胞计数增加(1级)。 3、天龙药业:YKYY015注射液 作用机制:靶向PCSK9小核酸 适应症:高胆固醇血症、高脂血症 8月13日,天龙药业的YKYY015注射液的IND获CDE受理。YKYY015是是一款靶向PCSK9基因的小干扰核糖核酸(siRNA)药物,采用了siRNA序列全新修饰模板,具有全新的序列;其独特之处在于偶联了公司自主研发、具有完全自主知识产权的GalNAc递送系统。该药物有望通过一年2次注射,持续抑制肝脏中PCSK9蛋白的合成,高效降低血浆中的LDL-C水平。 临床前研究显示:(1)在人原代肝细胞评价实验中,YKYY015展现出对靶基因PCSK9的显著抑制作用,且呈现剂量依赖性,其IC50值小于1 nM。(2)人源化PCSK9小鼠体内药效学实验显示,YKYY015能够显著降低血浆中的hPCSK9蛋白水平,以及血清中的LDL-C和TC水平,同样呈现出剂量依赖关系。(3)在健康食蟹猴体内的药效学实验中,皮下注射YKYY015不仅显著降低了血浆中的PCSK9蛋白及肝脏中的PCSK9 mRNA水平,还同时降低了血浆中的LPa蛋白以及血清中的LDL-C和TC水平,这些抑制作用均呈现出剂量依赖性,并表现出良好的持久性。
国内创新药NDA汇总 1、健康元:TG-1000胶囊 作用机制:核酸内切酶抑制剂 适应症:流感 8月12日,健康元的TG-1000胶囊的新药上市申请(NDA)获CDE受理。TG-1000(Pixavir)是一种新型帽依赖性核酸内切酶抑制剂,最早由太景医药研发;2023年3月,健康元获得在许可区域(中华人民共和国,含香港及澳门特别行政区,但不包括台湾地区)内开发、制造和商业化TG-1000的权益。该药物具有起效快、抑制病毒时间长、耐受性好、口服不受食物影响的特点,能同时有效抑制甲型、乙型流感病毒。III期研究是一项多中心、随机、双盲临床试验,主要研究终点是治疗期15天内所有流感症状缓解的时间;初步统计分析结果表明,该药物与安慰剂组的所有流感症状缓解的中位时间分别为60.9小时和87.9小时,具有统计学差异;且未发生与药物相关的严重不良反应,安全性更高。 2、辉瑞:马塔西单抗注射液 作用机制:靶向TFPI单抗 适应症:血友病 8月13日,辉瑞的马塔西单抗注射液的上市申请获CDE受理,马塔西单抗(marstacimab,PF-06741086) 是一种靶向组织因子通路抑制剂(TFPI)的人源IgG1单克隆抗体,通过靶向TFPI的Kunitz-2结构域,重新建立出血和凝血之间的平衡;即使患者体内存在抑制剂,也能降低出血的发作次数;此外,该药物每周一次皮下注射的便利给药方式,有望提高患者的依从性。该药物递交上市申请主要基于一项全球性多中心、开放标签关键III期BASIS临床研究,结果显示marstacimab在降低年化出血率(ABR)方面具有显著的统计学意义和临床相关性,相比常规预防治疗和按需治疗,使体内不伴抑制物的血友病A及血友病B患者的年化出血率分别降低35%和92%;同时,在药物长期扩展研究中,患者在额外的16个月随访中,仍能观察到出血率持续下降。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..