3 月 29 日,据 CDE 官网显示,和黄医药呋喹替尼胶囊新适应症国内申报上市(受理号:CXHS2400023/4)。
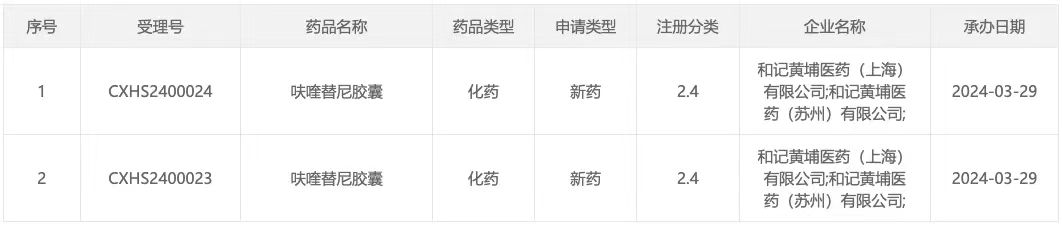
来自:CDE 官网
本月初,呋喹替尼已纳入优先审评,联合信迪利单抗注射液用于既往系统性抗肿瘤治疗后疾病进展且不适合进行根治性手术治疗或根治性放疗的晚期 pMMR 或 non MSI-H 子宫内膜癌患者,推测此次申报即为该适应症。
呋喹替尼于 2018 年 9 月在中国获批用于结直肠癌的治疗,由和黄医药与礼来公司合作开发并以商品名爱优特™ 上市销售。去年 11 月,获 FDA 批准上市,成为美国首个且唯一获批用于治疗经治转移性结直肠癌的针对全部三种 VEGF 受体激酶的高选择性抑制剂,无论患者的生物标志物状态如何。
在国内,和黄医药还递交了二线治疗胃癌的新药上市申请,已于去年 4 月被 NMPA 受理,当前正在审评中(受理号:CXHS2300043)。
针对子宫内膜癌,和黄医药启动了一项多中心、开放标签 I/II 期临床试验(登记号:NCT03903705/CTR20190514),旨在评估呋喹替尼和信迪利单抗的联合疗法的疗效和安全性。研究的入组标准包括既往接受含铂化疗后疾病复发、疾病进展或出现 3 级或以上严重不良事件的子宫内膜癌患者。研究的主要终点是 IRC 评估的 ORR,次要终点包括 DCR、无进展生存期 PFS、OS 和药代动力学评估。目前该研究已完成所有受试者的入组工作,共纳入了 142 名晚期经治子宫内膜癌患者。
呋喹替尼自上市后销售额也在持续增长,2023 年中国市场销售额增长 15%(按固定汇率计算为 22%)至 1.075 亿美元;在美国,11 月才上市,2023 年销售额也有 1510 万美元。
呋喹替尼是一种选择性的口服 VEGFR-1、-2 及-3 抑制剂。其被设计为拥有更高的激酶选择性,旨在降低脱靶激酶活性,从而实现更高的药物暴露、对靶点的持续覆盖以及当潜在作为联合疗法时拥有更高的灵活度。迄今为止,呋喹替尼展示出可控的安全性特征,与其他抗肿瘤疗法联合使用的研究正在进行中。
呋喹替尼二线治疗肾细胞癌的中国注册研究已于2023 年完成患者招募工作,预计于今年年底公布肾细胞癌的顶线结果。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..