2024年3月1日,CDE官网公示,科伦博泰的注射用SKB264的一项新适应症申请拟被纳入突破性治疗品种,针对适应症为:既往未接受过系统治疗的不可手术切除的局部晚期、复发或转移性PD-L1阴性三阴性乳腺癌患者。
SKB264是由科伦博泰研发的一款靶向TROP2的抗体药物偶联物(ADC),已先后获得CDE三项突破性疗法认定(BTD)。分别为:
局部晚期或转移性三阴乳腺癌(TNBC)
EGFR-TKI 治疗失败的局部晚期或转移性EGFR 突变非小细胞肺癌(EGFRm NSCLC)
既往接受过至少二线系统化疗的局部晚期或转移性激素受体阳性(HR+)和人表皮生长因子受体2阴性(HER2-)的乳腺癌
科伦博泰:收到SKB264/MK2870项目相关里程碑款项
截至本公告日,默沙东已分别公告启动了SKB264/MK2870单药针对经治疗晚期或转移性EGFR或其他基因突变的非鳞状非小细胞肺癌、单药针对经铂类化疗及免疫治疗后的子宫内膜癌以及联合帕博利珠单抗针对PD-L1表达大于等于50%的转移性非小细胞肺癌的三项全球三期临床试验。按照科伦博泰与默沙东双方协议约定并经默沙东书面确认,就非小细胞肺癌及子宫内膜癌的全球三期临床启动已触发相关临床里程碑的付款,合计金额7500万美金。科伦博泰目前已收到部分款项,剩余款项将于近期收到。
2023 年 12 月9日 ,CDE官网显示,科伦博泰自主研发的创新TROP-2 ADC SKB-264递交上市申请。2023年11 月 1 日,据 CDE 官网显示,拟将科伦递交的 SKB264 上市申请纳入优先审评,用于既往至少接受过 2 种系统治疗(其中至少1种治疗针对晚期或转移性阶段)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者。
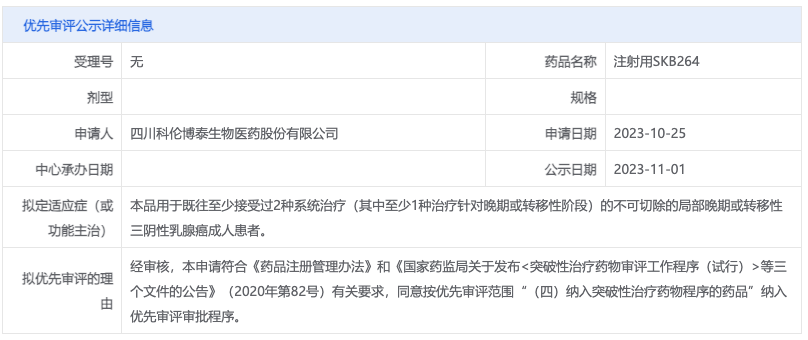
来自:CDE 官网
首先看下TNBC数据:
2022年12月6日,科伦博泰在第45届圣安东尼奥乳腺癌研讨会(SABCS)上以壁报形式公布了TROP2-ADC SKB264(MK-2870)用于局部晚期或转移性三阴乳腺癌(TNBC)患者II期拓展研究的最新疗效和安全性数据。简单整理如下:
• 试验方法:入组59例经治的局部晚期或转移性三阴乳腺癌患者接受SKB264单药治疗,每两周给药一次;
• 数据随访:截至2022年10月10日,中位随访时间12.8个月;
• 疗效数据:在55例可进行疗效评估的患者(4mg/kg组21例,5mg/kg组34例)中,确认的ORR为40%,DCR为80%;TROP2高表达患者确认的ORR为55.2% ,TROP2高表达5mg/kg剂量组确认的ORR高达62.5%;mDoR为11.5个月,mPFS为5.7个月,mOS为14.6个月,12个月OS率为66.4%;
• 安全性数据:57.6%的患者报告了≥3级的治疗相关不良事件(TRAEs)。最常见的≥3级TRAEs(≥10%)是中性粒细胞计数降低、白细胞计数降低、贫血和血小板计数降低。TRAEs导致10.2%的患者剂量降低。没有发生因TRAE导致的死亡,没有观察到间质性肺病(ILD)发生。
TNBC领域,安全性数据良好。
肺癌研究进度
2022年,科伦药业先后授予默沙东两款实体瘤ADC药物(靶向TROP2的SKB264和靶向Claudin18.2的SKB315)在全球范围内进行研发、生产与商业化权益。两款药物首付款合计8200万美元,里程碑付款合计22.64亿美元。都是未来潜在的重磅靶点ADC赛带产品,默沙东作为帕博利珠单抗时代的红利享受者,也得布局后PD-1时代的产品管线。
2023年10月10日,默沙东在Clinicaltrials.gov网站上注册了Trop2 ADC新药SKB264(MK-2870)治疗EGFR等突变的非小细胞肺癌的国际多中心三期临床。
该三期临床计划入组556例非小细胞肺癌患者,预计2027年5月初步完成。
EGFRm NSCLC 研究进度:
SKB264-Ⅲ-09研究是一项比较SKB264单药对比培美曲塞联合铂类治疗EGFR-TKI治疗失败的EGFR 突变的局部晚期或转移性NSCLC的有效性和安全性的随机、开放性、多中心Ⅲ期临床研究。计划入组356例患者,主要研究终点为IRC评估的无进展生存期(PFS)。全国牵头研究中心为中山大学肿瘤防治中心。临床登记号为:CTR20231535。NCT05870319
——2023年ASCO研究数据报道——
SKB264用于经治局部晚期或转移性非小细胞肺癌(NSCLC)患者的Ⅱ期拓展研究数据被2023 ASCO年会以壁报形式收录,首次释放了EGFR突变和驱动基因阴性人群的研究数据。
研究设计:
这是一项针对复发或难治性局部晚期/转移性NSCLC和其他肿瘤类型患者的1/2期、多中心、剂量递增/扩展研究(NCT04152499)
所有NSCLC患者均接受 SKB264 5 mg/kg IV Q2W
研究者每8周进行一次基于RECIST 1.1的肿瘤评估
入组了43例患者,EGFR突变型和EGFR野生型NSCLC患者各占50%左右(22例 vs 21例),其中76.7%(33/43)的患者既往接受过针对转移性疾病的2种及以上方案治疗。
研究结果:
截至2023年2月9日,共有43名患者(63%为男性,88%为ECOG PS 1,中位年龄58岁[44-74])入选。中位随访时间为11.5个月(mo;95%CI,10.4-12.2)。中位治疗持续时间为5.7个月(范围,0.5-14.1)。
在39名可评估疗效的患者中,ORR为44%(17/39,15名确诊,2名待定),中位DoR为9.3个月(范围,1.3+至11.2+),6个月DoR率为77%。
进一步亚组分析:
mEGFR患者的ORR为60%,DCR为100%,mDoR为9.3个月,mPFS为11.1个月,12月OS率为80.7%。
EGFR野生型患者(之前接受了包括抗PD-1/L1在内的中位2种治疗)的ORR为26.3%,DCR为89.5%(17/19),mDoR为9.6个月,12月OS率为60.6%。
67.4%(29/43)的患者有3级治疗相关不良事件(TRAE)。最常见的3级TRAE(发生在5%的患者中)是中性粒细胞计数减少(32.6%)、贫血(30.2%)、白细胞计数(WBC)减少(23.3%)、口腔炎(9.3%)、皮疹(7.0%)和淋巴细胞计数减少7.0%。大多数血液学毒性发生在治疗的前两个月内,并在不输血的情况下用粒细胞集落刺激因子或红细胞生成素治疗后消退。23.3%(10/43)的受试者因TRAE而出现剂量减少。未报告神经病变或与药物相关的ILD/肺炎。没有TRAE导致治疗中断或死亡。
研究结论:
在复发或难治性局部晚期/转移性NSCLC患者中,5 mg/kg Q2W的SKB264表现出令人鼓舞的抗肿瘤活性和可控的安全性。TRAE主要为血液学毒性。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..