2月19日,中国专注于眼科疾病的基因治疗领导者纽福斯生物科技有限公司(下称“纽福斯”)宣布公司核心产品纽惟佳®(Opvika,依哌艾多基眼用注射液),用于治疗ND4突变引起的Leber遗传性视神经病变(ND4-LHON),I/II期临床试验在美国完成所有患者入组及给药。
纽福斯正在美国进行一项评估基因治疗ND4突变相关的Leber遗传性视神经病变(LHON)安全性和有效性的I/II期、单臂、多中心临床研究,该项目的新药临床试验(IND)申请于2022年1月18日获美国食品药品监督管理局(FDA)许可,并于2023年6月完成了首例患者入组给药。
“我们非常感谢患者及其家属的信任和支持,以及所有研究人员的参与和奉献,他们在推进I/II期临床入组顺利完成中发挥了关键作用。”纽福斯创始人、董事长兼首席执行官李斌教授表示,“纽福斯已在创新药出海的道路上迈出了坚实的一步。In China, For Global,我们会努力将中国的医学科研成果推向世界,为全球的眼科疾病患者带来更多创新的基因疗法。”
本次临床试验的主要研究者(PI),来自美国斯坦福大学拜尔斯眼科研究所的Yaping Joyce Liao教授表示:“此次I/II期临床试验取得的重大进展令人振奋。LHON患者们正翘首以盼像纽惟佳®(Opvika)这样的新疗法能够给他们带来治愈的可能。我非常期待与纽福斯共同见证 I/II 期临床试验的结果。”
关于纽福斯
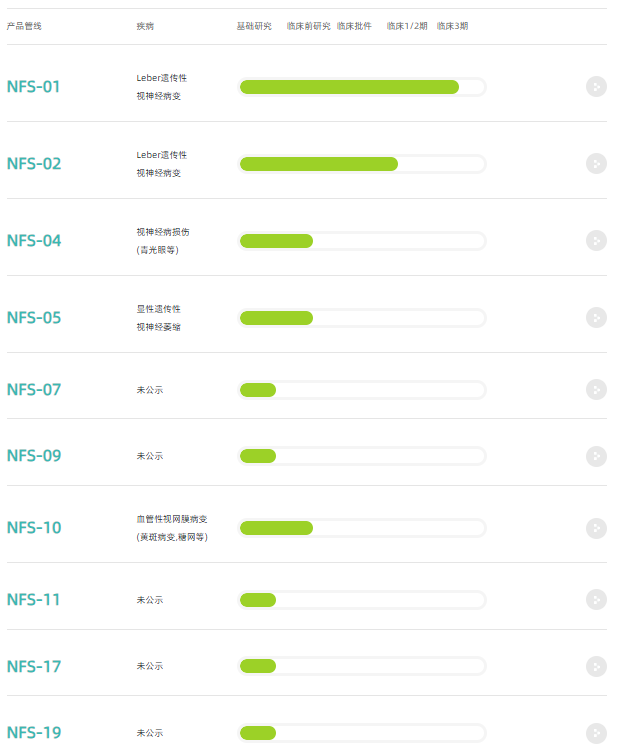
纽福斯是中国专注于眼科疾病的基因治疗行业领导者,在武汉、苏州、上海和美国圣地亚哥设有子公司,致力为全球患者研发针对遗传疾病的基因疗法。研究者发起的视网膜基因治疗研究的试验数据成功地验证了我们使用的AAV平台,研究结果已经发表在Nature-Scientific Report、Ophthalmology和EbioMedicine上。我们的核心产品纽惟佳®,旨在治疗ND4介导的Leber遗传性视神经病变(ND4-LHON),已被美国FDA和欧洲药品管理局(EMA)授予孤儿药称号(ODD),是首个同时获得中国NMPA及美国FDA授予的临床试验IND许可的中国籍基因治疗新药。目前已完成中国III期临床试验患者入组给药,及美国美国I/II期所有患者入组给药。公司第二款美国ODD新药NFS-02已被完成中美国际多中心I/II期临床试验首例患者入组给药。公司第三款基因治疗新药,针对ADOA的NFS-05已在澳洲获批临床试验。公司管线还包括光学神经保护,血管视网膜病变等临床前候选药物。
研发管线
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..