12月26日,卫健委发布了"第三批鼓励仿制药品建议清单"。截止目前,卫健委共公布一至三批鼓励仿制药品建议清单(以下简称"清单"),数量共计89个,涵盖抗癌药、罕见病药物、抗感染用药、抗肿瘤药及免疫调节剂、神经系统用药等多类别药品。笔者结合有关官方网站及第三方数据库,对本批品种进行了简要梳理如下,时间仓促,若有错漏,欢迎自行补充。
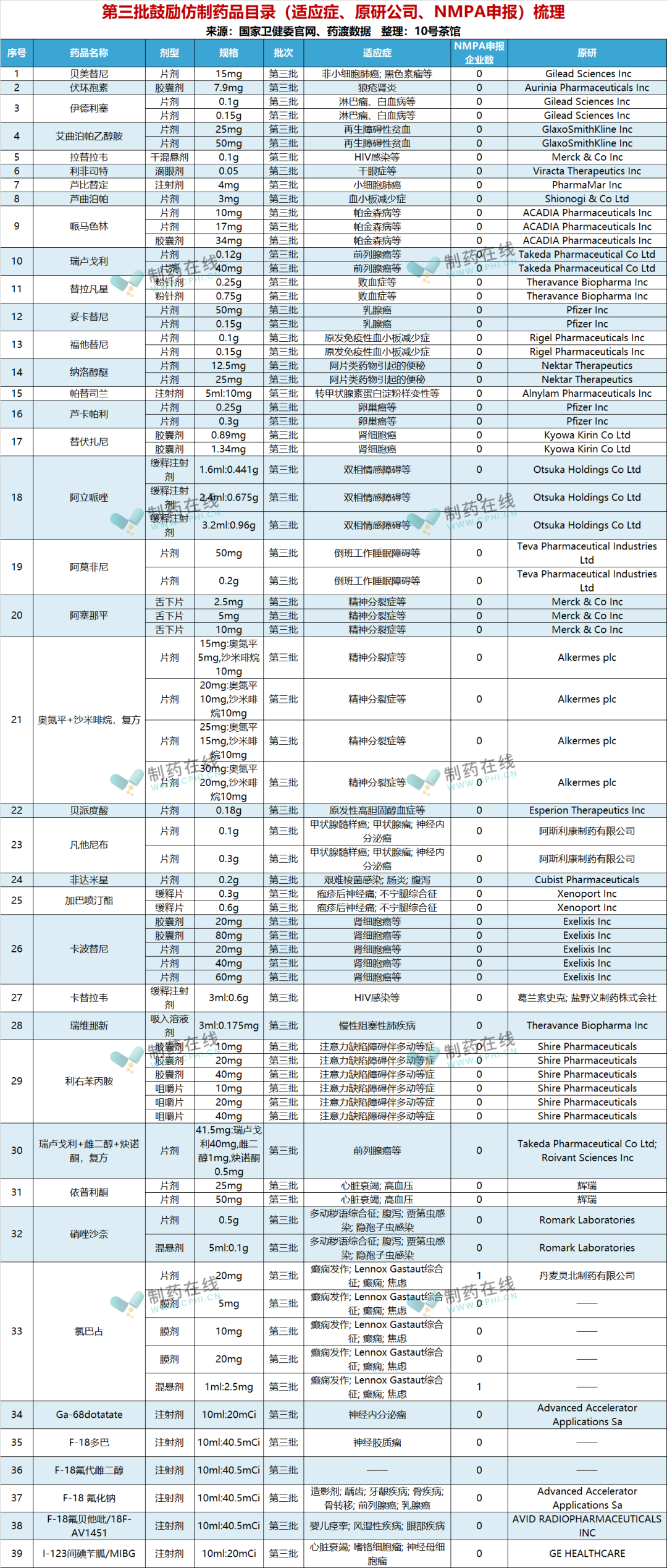
国家出台清单的背景是:2015年,国务院出台《关于改革药品医疗器械审评审批制度的意见》,随后,国家药品审评审批改革步入快车道:提高药品审评标准,设立快速审评审批通道、积极组织开展仿制药质量和疗效一致性评价。
为落实国务院办公厅2018年4月发布的《关于改革完善仿制药供应保障及使用政策的意见》和2018年12月国家卫生健康委等12部门《关于印发加快落实仿制药供应保障及使用政策工作方案的通知》,当时将鼓励仿制药的范围明确为"临床必需、疗效确切、供应短缺"的药品,由国家卫健委联合有关部委组织专家对国内专利到期和专利即将到期尚没有提出注册申请、临床供应短缺(竞争不充分)以及企业主动申报的药品进行遴选论证,先后于2019年10月、2021年2月发布了《第一批鼓励仿制药品目录》和《第二批鼓励仿制药品目录》。

从官方分析的角度,《清单》鼓励仿制的原因主要归纳为以下4个层面:
1、技术层面:填补国内临床用药空白。
2、覆盖层面:提高药品可及性与覆盖率。
3、制剂层面:鼓励创新制剂技术。片剂、胶囊剂、缓释注射、干混悬、舌下片及儿童剂型、复方制剂。
4、临床层面:提高临床诊断准确性。
而新版《药品注册管理办法》已于2020年7月1日正式实施,其中单独设计药品加快上市注册程序相关内容,就具有明显临床价值的创新药、仿制艾滋病、恶性肿瘤、重大传染病及罕见病等疾病的临床急需药品实行优先审评审批,彰显出国家支持以人民健康为中心、以临床价值为导向的思路。官方遴选第三批《清单》时,从"临床用药的必需性和企业研发的可行性"等角度,可谓考虑得非常周全:一是坚持临床需求为导向。二是兼顾企业研发可行性。
近年来,我国制药行业和技术不断发展,尽管与外资原研产品仍有一定差距,但研发和生产能力确实有了长足的进步。
而对企业来说,积极参与仿制这份清单,最大的利好就是在国谈层面可以弯道抄车,抢先进入医保。根据现行的《基本医疗保险用药管理暂行办法》有关规定:纳入鼓励仿制药品目录或鼓励研发申报儿童药品清单,且于2023年6月30日前,经国家药监部门批准上市的药品,可以参与国家医保目录调整。
同时,企业要想积极参与相关清单涉及的品种仿制,首先要考虑的因素同样还有很多,从立项角度,相应原研品种是否已经进入国内,包括相应的质量标准要求,都是企业要考虑的方面。同时,相应品种的市场容量有多少也是企业必须要重点考虑的层面。除此之外,在国家集采及地方集采持续开展的大背景下,得原料者得天下!有了原料药,就敢拼价格,因此,原料药的市场价格和可及性也是企业要重点考虑的层面。
关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..四川省医药保化品质量管理协会党支部开
为庆祝中国共产党成立104周年,持..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..四川省医药保化品质量管理协会党支部召
四川省医药保化品质量管理协会党支..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..关于收取2025年度会费的通知
各会员单位: 在过去的一年里,..“两新联万家,党建助振兴”甘孜行活动
为深入贯彻落实省委两新工委、省市..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..四川省应对新型冠状病毒肺炎疫情应急指
四川省应对新型冠状病毒肺炎疫情应..