12 月 6 日,诺华宣布,其在研 Iptacopan 获 FDA 批准上市,用于治疗成人阵发性睡眠性血红蛋白尿(PNH)。这是首个获 FDA 批准的口服单药治疗成人 PNH 新药。
Iptacopan 是由诺华研发的首个靶向补体旁路途径 B 因子的口服抑制剂。此次批准是基于关键性 III 期 APPLY-PNH 研究。该研究结果显示,Iptacopan 治疗 C5 经治后仍有残存贫血的 PNH 成人患者,显著优于继续使用抗 C5 疗法。
APPLY-PNH 研究结果
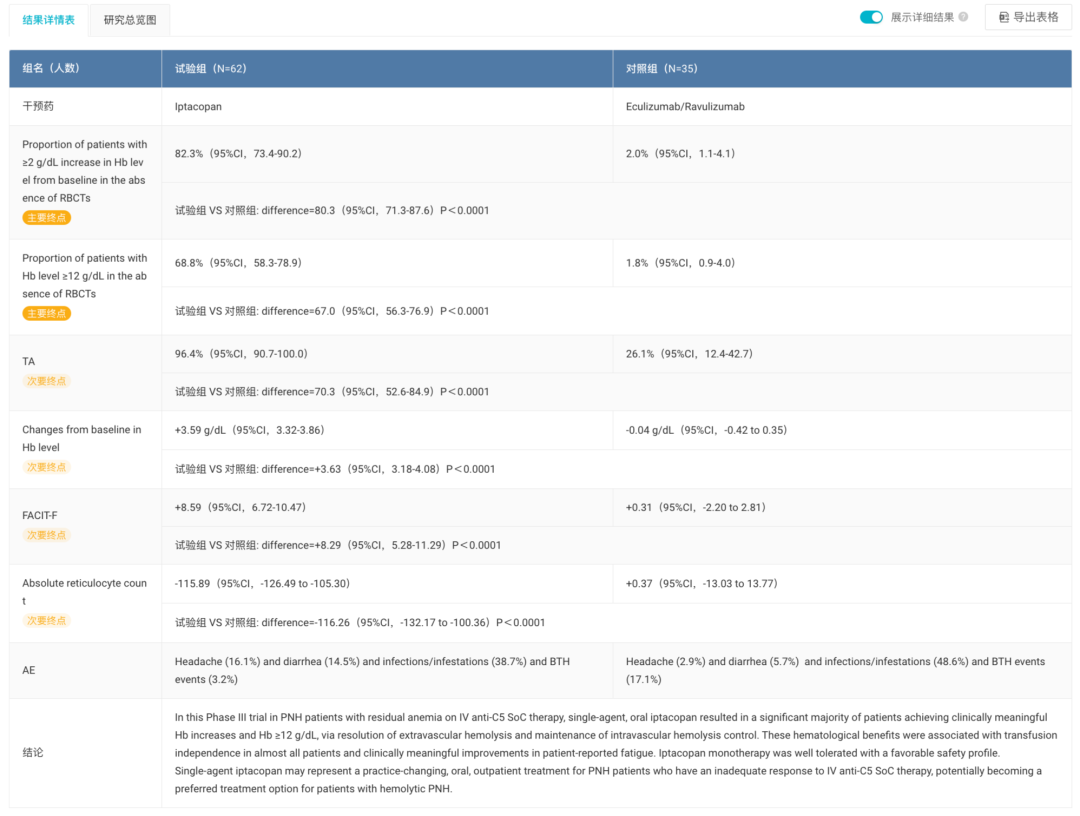
来自:Insight 数据库网页版
今年 4 月,诺华还披露了另一项 Iptacopan 治疗 PNH 患者的 III 期临床 APPOINT-PNH 研究(登记号:NCT04820530)数据。
该研究共纳入 40 名受试者,结果显示研究达到主要终点,Iptacopan 组血红蛋白较基线上涨 2g/dL 以上的患者比例达到 92.2%,次要终点方面,血红蛋白水平超过 12g/dL 的患者比例达到 62.8%,避免输血的比例达到 97.6%。
APPOINT-PNH 研究结果

来自:Insight 数据库网页版
阵发性睡眠性血红蛋白尿症 (PNH) 是一种补体介导的慢性罕见血液疾病。PNH 患者的造血干细胞 PIG-A 基因发生突变,导致其产生易于被补体系统过早破坏的红细胞。从而引发血管内溶血 (红细胞在血管内被破坏) 和血管外溶血 (红细胞在脾脏和肝脏中被破坏),临床主要表现为贫血、阵发性血红蛋白尿、骨髓造血功能衰竭和血栓形成等。
PNH 是一种严重影响患者生活质量的罕见病。据统计,发病率约百万分之一到二,亚洲人群发病率高于欧美。PNH 可在任何年龄发生,常见于 30-40 岁人群。
抗补体 C5 疗法 (依库珠单抗或 Ravulizumab) 是既往国际公认的 PNH 标准治疗,但在抗 C5 治疗后,仍有大部分患者有残留贫血、疲乏和输血依赖,严重影响生活质量。
Iptacopan 作为特异性补体 B 因子抑制剂,作用于 C5 末端通路的上游,同时控制血管内溶血和血管外溶血,弥补了抗 C5 抗体的不足,同时为患者提供了口服单药的选择。
在国内,Iptacopan 针对 PNH 适应症已于今年 6 月申报上市,并被纳入优先审评。
除 PNH 之外,据 Insight 数据库显示,Iptacopan 目前也处于其他许多补体介导疾病 (CMD) 的关键研究阶段,包括肾脏疾病 C3 肾小球病(C3 G)、IgA 肾病 (IgAN)、非典型溶血性尿毒症综合征(aHUS)、狼疮性肾炎(LN)以及免疫性血小板减少性紫癜(ITP)和冷凝集素病(CAD)等。
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..