近年来,抗体药物偶联物(ADC)的发展呈爆炸式增长。
2019年至2022年间,美国食品药品监督管理局(FDA)就批准了8种ADC。
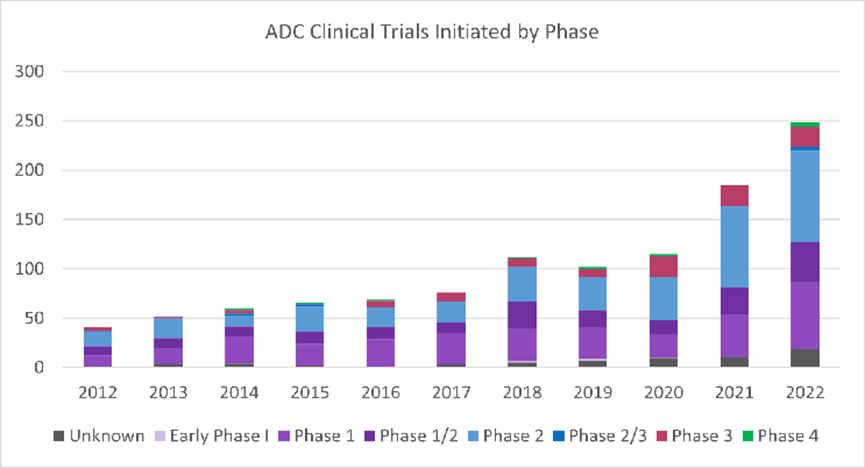
据clinical Leader报道,2022年,57种新ADC进入I期临床试验,与2021年相比增加了90%(图1)。此外,2022年启动了249项评估ADC的临床试验,与2021年相比增加了35%(图2)。
图1 从2012年到2022年,每年进入临床试验ADC情况
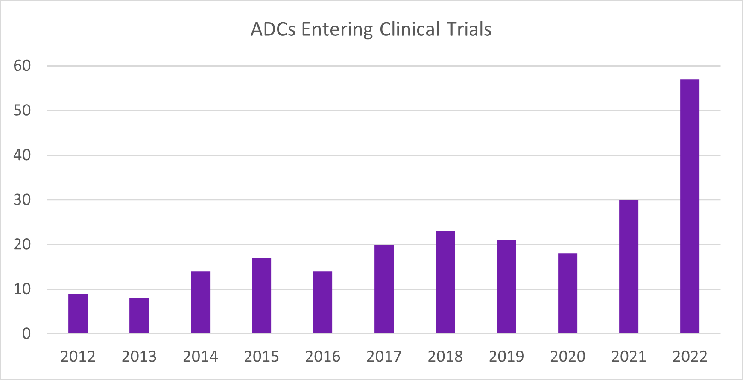
图2 从2012年到2022年,每年分阶段启动临床试验ADC情况
据估计,有100多个ADC正在临床开发的各个阶段进行研究,涵盖各种肿瘤类型。
在过去的二十年里,生物制药行业对ADC的每一个组成部分(包括抗体、偶联物、接头和有效载荷)都进行了重大投资研究,正在促使该领域进入繁荣期。
阿斯利康和第一三共的Enhertu(德曲妥珠单抗)的巨大成功将会进一步助推ADC开发热潮,越来越多的追随者希望复制该成功案例。
今年10月,礼来收购ADC公司Mablink Bioscience,并将其比作寻找PD-1抑制剂的竞赛,ADC或许是最有机会复制默沙东公司Keytruda的成功药物了。
回顾ADC开发历史:ADC并不是一项新技术。
20世纪80年代,第一批ADC开始进行临床试验,直到2000年,辉瑞公司的Mylotarg(吉妥珠单抗奥唑米星)才首次获批用于治疗急性髓细胞白血病(AML)。然而,Mylotarg随后退出市场,因为验证性试验未能显示其益处,并引发了安全问题。
尽管随后全球已有10多种ADC获批上市,安全性等问题一直是困扰该类药物发展的羁绊。寻找新一代ADC成为新的突破口。
直到2019年Enhertu首次获得批准上市。尽管Enhertu和老一代ADC药物Kadcyla头对头试验中取得疗效胜利,但同样也存在安全性风险,因在多个适应症中发现会引发间质性肺炎,且被FDA列入了黑框警告。
此前,业界一直认为ADC安全性问题主要驱动因素是有效载荷过早释放,现在看来,这不再是主要或唯一的问题,ADC毒性的驱动因素还有很多问题,ADC仍有一些挑战需要克服,包括毒性和肿瘤微环境本身。
即使是非常非常稳定的ADC也存在毒性问题,不过了解ADC毒性的分子基础将是向前迈出的重要一步。
作为目前ADC佼佼者的Enhertu,竞争者同样希望能够复制成功。
11月7日,百时美施贵宝与Orum Therapeutics达成协议,将向Orum支付1亿美元的预付款引进一款新型ADC药物ORM-6151。Orum对ORM-6151采取了不同的方法,ORM-6151是一种抗CD33抗体的GSPT1降解剂,正在开发中,用于治疗AML和高危骨髓增生异常综合征患者。与毒素不同,GSPT1降解剂非常擅长杀死AML细胞,但不擅长杀死造血干细胞。
正如礼来公司Loxo肿瘤学总裁Jake Van Naarden所言,摆在ADC这个领域面前的主要问题是:Enhertu是一个异类,还是可以复制?“我想我们不知道,我认为,任何一家公司都愿意在某种程度上支持ADC项目,这反映了他们的信念,即Enhertu的成功可以重复。”
四川省医药保化品质量管理协会党支部召
按照省市场监督管理局社会组织联合..关于举办2026年度四川省药品生产企业质
各药品生产企业: 2026年是我国..四川省医药保化品质量管理协会召开第七
2025年12月17日,四川省医药保化品..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..关于相关收费标准的公示
根据四川省医药保化品质量管理协会..协会党支部组织党日主题学习会
协会党支部组织党日主题学习会 --..